a) Các sản phẩm glycat hóa thành sản phẩm cuối cùng AGEs
Các sản phẩm lycat hóa thành AGEs là một nhóm không đồng nhất của các phân tử được hình thành bởi sự glucose gắn với các protein hoặc acid béo ở huyết tương mà không cần đến enzym. AGEs gây ra sự hư hại chức năng bình thường của các protein, mỡ bị glycat hóa do làm thay đổi cấu tạo nguyên tử của các phân tử này, làm hư hại các hoạt động của enzym và làm nhiễu loạn hoạt động của thụ cảm. Các AGEs bám vào tế bào da sẽ khiến da dần dần nhăn nheo, bám dính tế bào thận gây hư hại tế bào chân ở cầu thận, ở lòng vành, mạch thận, động mạch võng mạc, động mạch thẹn sinh dục, mạch ngoại vi...cũng vậy. AGEs là ứng cử viên sáng giá cho việc gây suy thận đái tháo đường, xơ vữa động mạch vành, bệnh võng mạc, liệt dục, hoại tử ngọn chi ... là những biến chứng của đái tháo đường.
Các AGEs tích tụ trong các dạng khác nhau của tế bào và tác động đến cấu trúc và hoạt động của ngoại bào và nội bào bởi liên kết ngang (cross-linking) không chỉ với các protein và còn cả với các lipid và các nucleic acid gây ra hàng loạt các biến chứng ĐTĐ. Liên kết ngang của các AGE với các thụ cảm của AGE có ở màng bào tương (RAGE) dẫn đến điều hòa làm tăng các yếu tố phiên mã như yếu tố hạt nhân kappa B ( nuclear factor-κB) và các gen đích của yếu tố này (target genes), làm sản sinh ra các phân tử gây viêm và các gốc tự do. Các AGE hòa tan hoạt hóa các đơn bào và các AGE ở màng cơ bản ức chế sự di chuyển của các đơn bào. RAGE gắn với AGE làm tăng tính thấm của nội mô đối với các đại phân tử. Các AGE ngăn chặn hoạt động của nitric oxide ở nội mô và làm sản sinh các chất oxy hóa phản ứng (ROS).
Thêm nữa, các AGR làm biến đổi các hạt LDL (cholesterol loại có hại) và cùng với sự làm hư hại mạch chúng thúc đẩy nhanh sự xơ hóa động mạch. Đã có các nghiên cứu đưa ra bằng chứng tăng các AGE ở các bệnh nhân ĐTĐ và mức tăng AGE ở các bệnh nhân bị bệnh động mạch vành.
b) Stress Oxy hóa
Stress oxy hóa xảy ra khi có sự sản xuất quá mức các chất oxy hóa phản ứng (ROS - gốc tự do). Stress oxy hóa có vai trò quan trọng trong việc hoạt hóa các con đường sinh bệnh khác của các biến chứng ĐTĐ bao gồm con đường polyol, sự glycat hóa không cần đến enzym và mức protein kinase C (PKC) và các con đường này là những con đường gây ra sự phát triển biến chứng vi mạch và biến chứng mạch máu lớn. Stress oxy hóa cũng làm bất hoạt hai enzym chống xơ vữa động mạch chủ yếu là enzym tổng hợp nitric oxide nội mô (endothelial nitric oxide synthase) và enzym tổng hợp prostacyclin (prostacyclin synthase). Tăng đường huyết làm thúc đẩy sự hình thành các ROS và các ROS này tương tác với deoxyribonucleic acid (DNA) lẫn các protein gây ra sự hủy hoại tế bào, đặc biệt là các DNA ty thể (mitochondrial DNA). Nghiên cứu trên tế bào nội mô võng mạc (endothelial cell - EC) đã cho thấy có sự xuất hiện sớm các hư hại DNA ty thể cùng với sự sản xuất quá mức các ROS gây ra bởi tăng đường huyết. Sự hư hại tế bào do ROS trung gian gây ra có thể hình thành nên “Trí nhớ” bệnh lý ở hệ vi mạch và trí nhớ này vẫn tiếp tục tồn tại kể cả sau khi đường huyết đã trở lại bình thường. Một số bằng chứng thực nghiệm đã chỉ ra rằng việc sản xuất quá mức superoxide ở ty thể là thủ phạm chính gây ra sự phát triển các bất thường về chuyển hóa trong bệnh ĐTĐ. Ở các bệnh nhân ĐTĐ type 2, kháng insulin làm sản sinh các ROS từ các axit béo tự do ở ty thể và ức chế các enzym chống xơ vữa động mạch gây ra xơ vữa động mạch và bệnh cơ tim. Trong số các bệnh nhân không bị ĐTĐ hoặc không có hư hại về dung nạp glucose, 1/5 của nhóm có kháng insulin cao nhất có nguy cơ bệnh tim mạch mạn tính gấp 2 lần so với 1/5 nhóm có kháng insulin thấp nhất sau khi đã có điều chỉnh một số yếu tố gây nguy cơ bệnh tim mạch như LDL, triglyceride, lipoprotein nồng độ cao, áp huyết tâm thu và hút thuốc.
Một số con đường tham gia vào việc gây biến chứng của ĐTĐ như sự hình thành AGE, hoạt hóa PKC, làm tăng dòng polyol và hình thành hexosamine cũng liên kết với stress oxy hóa dẫn đến việc thúc đẩy các biến chứng mạch máu lớn qua nhiều cơ chế. Sự tăng tập trung glucose có thể hoạt hóa yếu tố nhân kappa B (nuclear factor-κB), một chất trung gian chủ yếu điều hòa nhiều gen gây xơ vữa động mạch và gây viêm trong các tế bào cơ trơn của mạch, các tế bào nội mô và các đại thực bào. Sự tăng đường huyết tự nó đã kích thích stress oxy hóa và stress oxy hóa thực sự là yếu tố làm tăng nhanh xơ vữa động mạch.
c) Viêm nhẹ nội mạc lòng mạch
Viêm được thừa nhận là một trong các yếu tố rất nguy hiểm gây ra bệnh xơ vữa động mạch và ĐTĐ type 2. Các tế bào mạch sớm phải đương đầu với nhiều thay đổi bệnh sinh để đáp ứng với sự tăng đường huyết dẫn đến việc mất đi đặc tính không kết dính và kết dính của các đơn bào đối với các tế bào nội mô (EC) mà đó chính là bước đầu của sự xơ vữa động mạch. Sự gắn kết giữa tăng đường huyết với các AGE cùng với stress oxy hóa có thể kích thích việc sản xuất superoxide của tế bào nội mô (Hình 1). Glucose cũng hoạt hóa enzym metalloproteinase thoái hóa matrix (matrix-degrading enzyme metalloproteinase) mà enzym này gây ra việc phá vỡ các mảng và làm thay đổi động mạch cũng như sản xuất ra các tế bào cơ trơn của mạch, làm thay đổi sự di chuyển và làm thay đổi hoạt động của mạch. Vai trò của yếu tố hoại tử u alpha trong việc làm cho kháng insulin phát triển đã rất rõ ràng. Một số yếu tố gây viêm khác như protein phản ứng C (C-reactive protein), fibrinogen, ức chế hoạt hóa plasminogen I (plasminogen activator inhibitor I) và interleukine-6 làm tăng gây bệnh ĐTĐ. Đã có báo cáo về sự hoạt hóa của đơn bào khi tăng đường huyết tạo ra các chất trung gian gây viêm như PKC và yếu tố nhân kappka B (nuclear factor-κB) dẫn đến thúc đẩy stress oxy hóa.
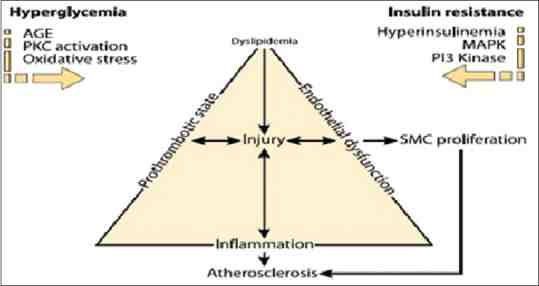
Kháng insulin và tăng đường huyết gây ra xơ vữa động mạch
d, Sự tạo mới mạch máu tân tạo (Neovascularization of vasa vasorum)
Sự sản sinh ra các mạch tân tạo liên quan chặt chẽ với sự tăng tiến triển dẫn đến xơ vữa động mạch. Nhiều quá trình của tế bào như viêm, di chuyển các mảng mạch tân tạo, sự xuất huyết đồng thời với các mảng mạch bên trong mang tính quyết định trong việc phát triển các mảng xơ vữa động mạch và có kiên kết với sự sản sinh mạch tân tạo (vasa vasorum). Sự sản sinh các mạch mới phát triển cả theo hướng ra ngoài lẫn theo hướng vào trong màng nội mạc. Trong bệnh ĐTĐ type 2, sự vỡ các mảng gắn liền với sự tăng bệnh tạo mạch máu mới (angiogenesis) và bệnh xơ vữa động mạch đái tháo đường bị gia tăng bởi sự tạo mới mao mạch của hệ mạch mới (neovasculature microangiopathy). Đáp ứng sinh mạch ban đầu ở mạch của mạch ngoại mạc (adventitial vasa vasorum), một thành phần quan trọng của cơ chế cân bằng nội môi dường như bị kích thích bởi sự thiếu oxy thông qua sự có mặt của yếu tố gây ra thiếu oxy và hoạt động của yếu tố tăng trưởng nội mô.
VEGF, một cytokin đa chức năng cũng góp phần gây biến chứng vi mạch bằng việc làm tăng tính thấm của mạch đối với các đại phân tử, làm tăng chemotaxis của đơn bào và sự sản xuất yếu tố mô. Cũng đã có báo cáo về điều hòa làm tăng VEGF trong các mô hình thực nghiệm bệnh thận đái tháo đường. Tuy vậy, ngược lại với điều trên, việc điều trị VEGF (VEGF treatment) lại cho thấy khôi phục được sự vi tuần hoàn (microcirculation) của mạch thần kinh (vasa nervorum) và làm hạn chế bệnh thận đái tháo đường như được thấy trong thực nghiệm chuyển gen của chuột. Ở mắt, yếu tố có nguồn gốc từ biểu mô của sắc tố có yếu tố thần kinh (neurotropic factor-pigment epithelium-derived factor - PEDF) có thể bù đắp lại được hoạt động của VEGF bằng cách ức chế sự sinh mạch mới tiềm năng. Sự giảm PEDF cũng chắc chắn góp phần vào việc gây bệnh thận đái tháo đường. Các yếu tố tăng trưởng khác như yếu tố tăng trưởng giống insulin 1, yếu tố tăng trưởng nguyên bào sợi cơ bản, yếu tố tăng trưởng tế bào gan cũng làm tăng bệnh thận tăng sinh.
Doctor SAMAN
Biên dịch và Viết: TS Đỗ Văn Lộc






![[Infographic] Nồng độ cồn trong máu](/yhbd.vn/upload/images/2015/05/NONG-DO-CON-TRONG-MAU-yhocbandia.png)
















































![[INFOGRAPHIC] NHỮNG BƯỚC NHỎ TẠO RA NHỮNG THAY ĐỔI LỚN](/yhbd.vn/upload/images/2015/04/thaydoilon-yhocbandia.jpg)
![[INFOGRAPHIC] 15 LÝ DO BẠN NÊN UỐNG NƯỚC CHANH VÀO MỖI SÁNG](http://yhocbandia.vn/yhbd.vn/upload/images/2015/04/nuoc-chanh.jpg)
![[INFOGRAPHIC] SỨC MẠNH CỦA NỤ CƯỜI](/yhbd.vn/upload/images/2013/04/nu-cuoi-yhocbandia.jpg)
![[INFOGRAPHIC] 18 SỰ THẬT KINH NGẠC VỀ CƠ THỂ CON NGƯỜI](/yhbd.vn/upload/images/2015/04/18-yhocbandia.jpg)











