MỘT ĐẦU DÒ HUỲNH QUANG BƯỚC SÓNG DÀI DỰA TRÊN PHẢN ỨNG ĐỂ PHÁT HIỆN CU2+ VÀ HÌNH ẢNH TRONG TẾ BÀO SỐNG
Khac Hong Nguyen[1], Yuanqiang Hao, Ke Zeng, Xiuhua Wei, Suke Yuan, Fen Li, Shengnan Fan, Maotian Xu, and You-Nian Liu
1. GIỚI THIỆU
Đồng (Cu) là nguyên tố vi lượng phong phú thứ ba trong cơ thể người, đóng nhiều vai trò quan trọng trong các quá trình sinh lý khác nhau, chẳng hạn như duy trì cấu trúc protein, tham gia vào quá trình hô hấp tế bào, biểu hiện gen và các phản ứng enzym-kim loai. Tuy nhiên, mức độ bất thường và rối loạn chuyển hóa của Cu có thể dẫn đến Stress oxy hóa có liên quan đến các bệnh thoái hóa thần kinh nghiêm trọng, bao gồm bệnh Parkinson, bệnh Alzheimer, bệnh Menkes và Wilson, bệnh xơ cứng teo cơ một bên và bệnh Prion. Ngoài ra, ion Cu đã trở thành một chất gây ô nhiễm môi trường nghiêm trọng do ứng dụng công nghiệp rộng rãi của nó. Và Cơ quan Bảo vệ Môi trường Hoa Kỳ (EPA) đã đặt mức tối đa cho phép (1,3 ppm, ~ 20 μM) của Cu2+ trong nước uống. Do đó, việc phát hiện hiệu quả Cu2+ trong cả môi trường và hệ sinh vật là vô cùng quan trọng. Cho đến nay, các phương pháp khác nhau, chẳng hạn như phép đo phổ hấp thụ nguyên tử (AAS), phép đo phổ phát xạ nguyên tử plasma kết hợp cảm ứng (ICP-AES), quang phổ khối lượng plasma cảm ứng (ICP-MS), phép đo màu, phép đo flo và phép đo Vôn, đã được sử dụng cho việc phát hiện các ion đồng.
Trong số các kỹ thuật khác nhau, các xét nghiệm dựa trên đầu dò huỳnh quang đã thu hút rất nhiều sự quan tâm do độ nhạy và độ chọn lọc cao, đơn giản để thực hiện, phản ứng nhanh, độ phân giải không gian và thời gian cao, và khả năng tương thích sinh học tốt. Cho đến nay, hai chiến lược đã được sử dụng để thiết kế các đầu dò Cu2+ huỳnh quang:
i) dựa trên liên kết thuận nghịch, không cộng hóa trị của Cu2+ với các nguyên tố nhất định;
ii) dựa trên sự biến đổi hóa học không thuận nghịch tạo ra Cu2+ của đầu dò. Do tính chất thuận từ nội tại của Cu2+, hầu hết các đầu dò này dựa trên chiến lược cũ hiển thị các hành vi huỳnh quang Bật-Tắt, điều này không thuận lợi cho việc phát hiện và hình ảnh sinh học.
Đáng chú ý, các đầu dò dựa trên phản ứng thường biểu hiện phản ứng huỳnh quang bật hoặc theo tỷ lệ, đã khai thác khả năng phản ứng độc nhất của ion đồng, bao gồm mở vòng spirolactam do phối trí Cu2+, quá trình oxy hóa tạo ra Cu2+, khử thiol tạo ra Cu2+, Cu2+ có quá trình oxi hóa tạo ra chu kỳ và sự thủy phân tạo ra Cu2+. Trong số các đầu dò dựa trên phản ứng này, lần đầu tiên báo cáo một đầu dò Cu2+ huỳnh quang bật sáng sử dụng picolinate làm gốc nhận biết. Ion đồng có thể thúc đẩy quá trình thủy phân của đầu dò một cách chọn lọc để giải phóng axit picolinic và hydroxycoumarin phát quang mạnh. Gần đây, cách tiếp cận này đã được thích nghi rộng rãi để thiết kế các đầu dò huỳnh quang tỷ lệ bật hoặc bật khác nhau cho Cu2+. Hầu hết các đầu dò huỳnh quang được báo cáo này hiển thị dải kích thích hoặc phát xạ trong dải cực tím hoặc bước sóng ngắn, điều này không thuận lợi cho các ứng dụng sinh học. Đáng chú ý, các đầu dò huỳnh quang với các tính năng phát tia đỏ đã thu hút rất nhiều sự chú ý do khả năng thâm nhập mô cao và loại bỏ tự động huỳnh quang nền trong các xét nghiệm sinh học.
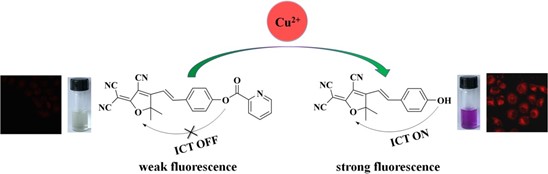
Chúng tôi báo cáo ở đây một đầu dò huỳnh quang phát xạ đỏ (đầu dò 1) để phát hiện Cu2+ bằng cách kết hợp gốc picolinate vào dicyanomethylenedihydrofuran (DCDHF). Là một khung soi huỳnh quang hấp dẫn, DCDHF có cả dải kích thích và dải phát xạ trong dải bước sóng dài (>580 nm) và đã được sử dụng để chế tạo các đầu dò huỳnh quang khác nhau. Đầu dò 1 hầu như không được phép do quá trình truyền điện tích nội phân tử (ICT) bị ức chế trong phân tử đầu dò. Việc bổ sung Cu2+ có thể tạo ra một quá trình thủy phân cụ thể để phân cắt gốc picolinate và giải phóng chất huỳnh quang cao DCDHF fluorophore, và do đó đạt được phản ứng huỳnh quang bật lên với Cu2+. Ngoài ra, khi phản ứng với Cu2+, sự hấp thụ của đầu dò 1 cho thấy sự thay đổi sắc độ âm đáng kể từ 400 đến 590 nm, tương ứng với sự thay đổi màu có thể nhìn thấy rõ ràng từ vàng sang tím. Phản ứng phổ cụ thể của đầu dò 1 đối với Cu2+ cũng thể hiện độ nhạy cao (giới hạn phát hiện là 54 nM). Hơn nữa, các thí nghiệm về độc tính tế bào và hình ảnh đã chứng minh khả năng tương thích sinh học tuyệt vời của đầu dò và khả năng phát hiện Cu2+ trong tế bào sống.
2. THỰC NGHIỆM
2.1. Hóa chất và dụng cụ
Tất cả các hóa chất để tổng hợp đều được lấy từ các nhà cung cấp thương mại và được sử dụng như đã nhận. Nước millipore được sử dụng để chuẩn bị tất cả các dung dịch nước. Quang phổ hấp thụ được ghi lại bằng máy quang phổ Varian Cary 60 (Agilent Technologies, Santa Clara, USA) và quang phổ huỳnh quang được ghi lại bằng máy quang phổ huỳnh quang Varian Cary Eclipse (Agilent Technologies, Santa Clara, USA). Phổ NMR được thu thập trong CDCl3 trên máy quang phổ Bruker AVQ-400. Phép đo khối phổ được thực hiện trên máy đo khối phổ Waters Xevo G2SQTof ™ (Waters, Milford, MA, USA). Phân tích HPLC được thực hiện trên hệ thống Waters Acquity UPLC H-Class (Milford, MA, Hoa Kỳ) được trang bị hệ thống phân phối dung môi bậc bốn, tủ sấy cột, bộ lấy mẫu tự động và máy dò mảng diode quang. Các chất phân tích được tách ở chế độ gradient với cột Waters ACQUITY BEH 2.1×50 mm C18 1.7 μm. Lò cột được giữ ở 40oC. Tốc độ dòng chảy là 0,5 mL / phút. Các thành phần rửa giải là nước (A) và axetonitril (B). Gradient pha động như sau: tỷ trọng của pha B tăng từ 50 lên 100% trong 4,0 phút. Bước sóng phát hiện được đặt ở 420 nm.
2.2. Quy trình chung để phân tích
Tất cả các phép đo quang phổ được thực hiện trong dung dịch hỗn hợp của đệm photphat: DMSO = 9:1 (v/v, pH 7,4, 10 mM). Dung dịch gốc của đầu dò 1 được chuẩn bị trong DMSO (10 mM). Tất cả các ion kim loại đều có nguồn gốc từ muối clorua của chúng, ngoại trừ Pb2+, được phân phối ở dạng nước Pb(NO3)2. Đối với các phép thử huỳnh quang, độ rộng khe kích thích và phát xạ lần lượt là 5 nm và 5 nm.
2.3. Hình ảnh hiển vi huỳnh quang
Tế bào Hela nuôi cấy được ủ với đầu dò 1 (10 μM), đầu dò 1 (10 μM) và do đó với Cu2+ (10 μM) trong DMEM ở 37oC, tương ứng. Thời gian ủ được đặt là 1h. Sau khi ủ trong thời gian tương ứng, các tế bào được rửa bằng PBS ba lần để loại bỏ hợp chất và ion tự do trước khi phân tích. Chụp ảnh huỳnh quang được thực hiện với Olympus IX71 với đèn Xenon và máy ảnh kỹ thuật số Olympus. Sự phát huỳnh quang trong kênh màu đỏ được hình dung bằng các bộ lọc phát xạ thích hợp.
2.4. Thử nghiệm khả năng sống của tế bào
Độc tính của mẫu dò 1 đối với tế bào sống được xác định bằng các xét nghiệm MTT (3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide). Ba loại dòng tế bào (tế bào HeLa, A549 và MDA-MB-231) đã được đánh giá. Các tế bào được gieo hạt trong các đĩa 96 giếng với mật độ 5×103 tế bào / giếng và được nuôi cấy trong 24h ở 37oC với 5% CO2 trong môi trường được làm ẩm. Sau đó, một loạt các nồng độ đầu dò khác nhau (0,5, 10, 15 và 20 μM) được thêm vào các giếng đã tách, và các tế bào được ủ thêm 24h. Dung dịch MTT sau đó được thêm vào từng giếng và dung dịch MTT dư được loại bỏ sau 4h. Các tinh thể MTT-formazan được hòa tan trong 200 μL DMSO. Độ hấp thụ của mỗi giếng được đo bằng đầu đọc vi tấm (Bio-TekELx800) ở bước sóng 490 nm. Khả năng sống sót của tế bào được đánh giá bằng công thức sau: Khả năng sống của tế bào (%) = AT/A0 × 100%, trong đó AT là độ hấp thụ của các tế bào được xử lý và A0 là độ hấp thụ đối chứng. Dữ liệu về khả năng sống sót của tế bào được đưa ra dưới dạng trung bình ± độ lệch chuẩn (S.D.).
2.5. Tổng hợp đầu dò 1
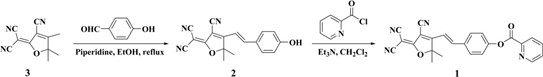
Scheme 1. Synthesis of probe 1.
Lộ trình tổng hợp đến đầu dò 1 được mô tả trong Sơ đồ 1. Hợp chất 3 và 2 được chuẩn bị theo các quy trình được báo cáo. Đầu dò 1 thu được trực tiếp bằng cách ghép hợp chất 2 với picolinat. Tóm lại, pyridin-2-cacbonylclorua (112 mg, 0,79 mmol) và trietylamin (334 mg, 3,21 mmol) được thêm vào dung dịch 2 (200 mg, 0,66 mmol) trong CH2Cl2 khan (10 mL) ở 0oC. Sau khi khuấy 0,5h, hỗn hợp được làm ấm đến nhiệt độ phòng và khuấy 2 giờ nữa. Sau đó, hỗn hợp phản ứng được cô đặc đến khô. Tinh chế bằng sắc ký cột (Silica, DCM – EtOAc làm chất rửa giải, 3:1, v/v) thu được 1 là chất rắn màu vàng (169 mg, 63%).
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Đặc điểm quang phổ của đầu dò 1 đối với Cu2+
Các đặc tính quang phổ của đầu dò 1 được nghiên cứu trong dung dịch đệm photphat (pH 7,4, 10 mM, H2O:DMSO = 9:1, v/v). Đầu dò 1 cho thấy một dải hấp thụ ở khoảng 400 nm (Hình 1A, đường cong a) và phát xạ rất yếu (ΦF = 0,0021) (Hình 1 B, đường cong a). Khi thêm Cu2+ (1N) vào dung dịch đầu dò, dải hấp thụ dịch chuyển đến 590 nm (Hình 1 A, đường cong b) tương ứng với sự thay đổi màu rõ rệt từ vàng sang tím (Hình 1 A), và phát xạ huỳnh quang tăng đáng kể ở bước sóng 610 nm (ΦF = 0,023). Những thay đổi quang phổ này cho thấy rằng đầu dò 1 có thể được sử dụng để phát hiện Cu2+.
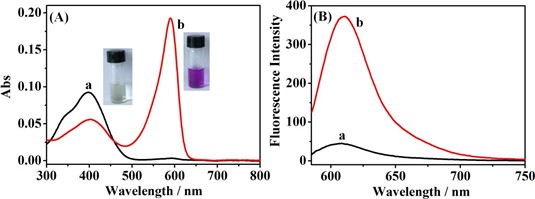 Fig. 1. (A) Absorption and (B) fluorescence emission spectra of probe 1 (10 μM) before (a) and after (b) reaction with Cu2+ (10 μM) in a solution of phosphate buffer (pH 7.4, 10 mM, H2O:DMSO = 9:1, v/v). λex = 580 nm. The inset shows their corresponding photographic images.
Fig. 1. (A) Absorption and (B) fluorescence emission spectra of probe 1 (10 μM) before (a) and after (b) reaction with Cu2+ (10 μM) in a solution of phosphate buffer (pH 7.4, 10 mM, H2O:DMSO = 9:1, v/v). λex = 580 nm. The inset shows their corresponding photographic images.
Sau đó, động học của phản ứng giữa đầu dò 1 và Cu2+ được khảo sát bằng cách ghi lại cường độ huỳnh quang phụ thuộc thời gian của dung dịch đầu dò ở bước sóng 610 nm với sự hiện diện của các nồng độ Cu2+ khác nhau (Hình 2A). Cường độ huỳnh quang cho thấy sự gia tăng phụ thuộc vào nồng độ Cu2+. Đầu dò 1 cho thấy cường độ phát xạ không thay đổi khi không có Cu2+, trong khi quan sát thấy nó bị thủy phân hoàn toàn khi có một đương lượng. của Cu2+ trong vòng 10 phút. Và cường độ huỳnh quang đạt mức ổn định trong vòng 10 phút ở mỗi nồng độ Cu2+ được kiểm tra. Do đó, 10 phút được chọn là thời gian phản ứng tối ưu. Mặc dù, như một phản ứng có xúc tác, quá trình thủy phân do Cu2+ tạo ra phải tiến hành cho đến khi cạn mẫu thử. Người ta vẫn quan sát thấy rằng phản ứng thủy phân chậm dần với thời gian phản ứng ở nồng độ thấp của Cu2+, điều này có thể là do khả năng phản ứng của Cu2+ giảm do liên kết với axit picolinic được giải phóng. Để kiểm tra thêm phản ứng giữa đầu dò 1 với Cu2+, phân tích lô đã được tiến hành (Hình S4). Cường độ phát xạ cực đại xuất hiện khi phần mol của Cu2+ gần bằng 0,4 cho thấy phép đo phân cực biểu kiến (Cu2+/ Đầu dò 1) là 2: 3. Tiếp theo, chúng tôi kiểm tra ảnh hưởng của pH đến phản ứng huỳnh quang của đầu dò 1 đối với Cu2+. Hình 2B cho thấy cường độ huỳnh quang phụ thuộc vào pH của đầu dò 1 ở bước sóng 610 nm khi có và không có Cu2+. Khi có mặt Cu2+, cường độ huỳnh quang tăng lên đáng kể khi pH thay đổi từ 6,0 đến 9,0, cho thấy rằng phản ứng thủy phân tạo ra Cu2+ của đầu dò 1 tiến hành dễ dàng hơn trong điều kiện cơ bản. Cường độ huỳnh quang giảm mạnh khi pH dung dịch tăng cao hơn nữa (> 9,0) có thể được coi là hiệu ứng dập tắt của ion Cu2+ thuận từ. Khi không có Cu2+, cường độ huỳnh quang không thay đổi khi pH <7,0 và tăng rõ ràng ở pH> 8,0, có thể cho rằng môi trường pH cao (> 7,0) có thể gây ra sự thủy phân của đầu dò 1. Dựa trên các nhận xét trên, chúng tôi đã chọn pH = 7.4 trong dung dịch đệm photphat là điều kiện tối ưu cho các phép thử phổ tiếp theo. Hiệu ứng dung môi cũng được kiểm tra bằng cách ghi lại phổ huỳnh quang của đầu dò 1 với sự có mặt của Cu2+ trong các hệ dung môi khác nhau, bao gồm các loại dung môi hữu cơ khác nhau, các tỷ lệ thể tích khác nhau của dung môi hữu cơ trên dung dịch đệm (Hình S5). Với tỷ lệ dung môi hữu cơ cao (50%), xét nghiệm hiển thị rõ ràng các hành vi huỳnh quang khác nhau đối với các loại dung môi đa dạng. Trong khi ở tỷ lệ cao (90%) của dung dịch đệm nước, các cấu hình huỳnh quang này gần như giống hệt nhau. Xem xét khả năng hòa tan cũng như khả năng tương thích để ứng dụng thực tế, chúng tôi lựa chọn hệ dung môi đệm phosphat: DMSO (v: v = 9: 1, pH 7.4, 10 mM).
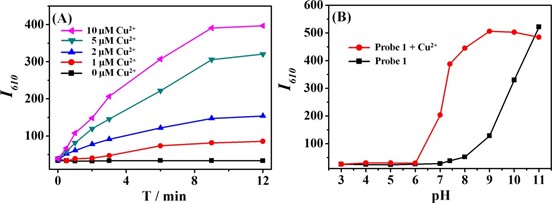 Fig. 2. (A) Time-dependent fluorescence intensity changes of probe 1 (10 μM) at 610 nm in presence of different concentrations of Cu2+; (B) Effect of pH on the fluorescence intensity of probe 1 (10 μM) in the absence and presence of Cu2+ (10 μM). λex = 580 nm.
Fig. 2. (A) Time-dependent fluorescence intensity changes of probe 1 (10 μM) at 610 nm in presence of different concentrations of Cu2+; (B) Effect of pH on the fluorescence intensity of probe 1 (10 μM) in the absence and presence of Cu2+ (10 μM). λex = 580 nm.
3.2. Độ nhạy và tính chọn lọc
Để xác định định lượng Cu2+, chúng tôi thực hiện thí nghiệm chuẩn độ huỳnh quang. Hình 3 cho thấy phổ phát xạ của đầu dò 1 (10 μM) với việc bổ sung các nồng độ Cu2+ khác nhau từ 0,1 đến 10 μM. Cường độ huỳnh quang của dung dịch mẫu dò ở bước sóng 610 nm tăng dần theo lượng Cu2+, và đạt mức ổn định khi có mặt Cu2+ (8 μM). Mối tương quan tuyến tính tốt (R2 = 0,998) đã được quan sát giữa cường độ huỳnh quang và nồng độ Cu2+ trong khoảng 0,2–5 μM. Giới hạn phát hiện được tính là 54 nM, thấp hơn nhiều so với mức tối đa cho phép (1,3 ppm, ~ 20 μM) đối với ion Cu2+ trong nước uống do EPA Hoa Kỳ đặt ra. Hiệu suất của đầu dò 1 cũng được so sánh với các đầu dò Cu2+ huỳnh quang khác được báo cáo gần đây dựa trên gốc nhận biết của picolinate, như được thể hiện trong Bảng S2, đầu dò được đề xuất thể hiện hiệu suất phân tích tương đương hoặc vượt trội so với các đầu dò khác.
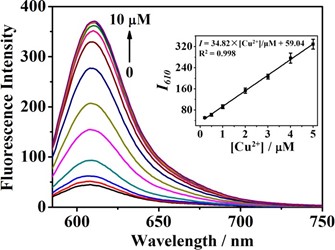
Fig. 3. (A) Fluorescence spectra of probe 1 (10 μM) in the presence of Cu2+ with various concentrations: 0, 0.2, 0.5, 1.0, 2.0, 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0 and 10.0
Để đánh giá độ chọn lọc của đầu dò 1 đối với Cu2+, các phản ứng huỳnh quang của 1 đối với các ion kim loại khác nhau (Hình 4A) đã được kiểm tra trong các điều kiện giống hệt nhau. Trong số các cation khác nhau (Al3+, Ag+, Ca2+, Cd2+, Co2+, Cu2+, Cr3+, Fe2+, Fe3 +, Hg2+, K+, Li+, Mg2+, Ni2+, Mn2+, Pb2+, Sn2+, Zn2+), chỉ có Cu2 + tạo ra sự tăng cường huỳnh quang đáng kể, trong khi những can thiệp khác không dẫn đến bất kỳ thay đổi rõ ràng nào. Hơn nữa, các thí nghiệm cạnh tranh (Hình 4B) tiết lộ rằng phản ứng huỳnh quang của đầu dò 1 với Cu2+ hầu như không bị ảnh hưởng khi có mặt các cation khác. Những kết quả này chứng minh rằng đầu dò 1 có độ chọn lọc tốt để phát hiện Cu2+ so với các ion kim loại khác.μM. Inset shows the linear fitting curve between the fluorescence intensity at 610 nm (I610) and the concentration of Cu2+. λex = 580 nm.
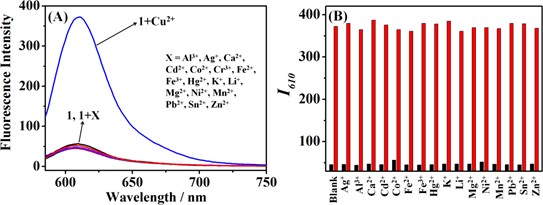 Fig. 4. (A) Fluorescence spectra of probe 1 (10 μM) in the presence of different metal ions (10 μM). (B) Fluorescence intensity of probe 1 (10 μM) at 610 nm upon the addition of different background cations (10 µM) (low bars), followed by addition of Cu2+ (10 μM) (high bars). λex = 580 nm.
Fig. 4. (A) Fluorescence spectra of probe 1 (10 μM) in the presence of different metal ions (10 μM). (B) Fluorescence intensity of probe 1 (10 μM) at 610 nm upon the addition of different background cations (10 µM) (low bars), followed by addition of Cu2+ (10 μM) (high bars). λex = 580 nm.
3.3. Cơ chế cảm biến
Phản ứng huỳnh quang nhạy cảm của đầu dò 1 đối với Cu2+ có thể là do quá trình thủy phân tái sinh thúc đẩy Cu2+ của este 2-picolinic mang trên đầu dò 1 để tạo ra hợp chất huỳnh quang 2 (Sơ đồ 2). Để xác nhận cơ chế cảm nhận này, phân tích HPLC đã được tiến hành. Như được mô tả trong Hình 5, đầu dò 1 và hợp chất 2 được phân lập có thời gian lưu lần lượt là 0,82 và 0,58 phút. Sau khi ủ đầu dò 1 (10 μM) với Cu2+ (2 μM) trong 15’, pic mới ở 0,58’ tương ứng với hợp chất 2 đã được quan sát rõ ràng và pic đại diện cho đầu dò 1 đã giảm đáng kể. Ủ đầu dò 1 (10 μM) với nồng độ Cu2+ (10 μM) cao cho kết quả sắc ký giống hệt như của hợp chất 2, chứng tỏ rằng mẫu dò đã được chuyển hoàn toàn thành hợp chất 2. Các kết quả sắc ký này đã chứng minh một cách thuyết phục rằng cơ chế cảm nhận của chất huỳnh quang này xét nghiệm dựa trên sự biến đổi Cu2+ do Cu2+ của mẫu dò 1 thành sản phẩm thủy phân của hợp chất 2.
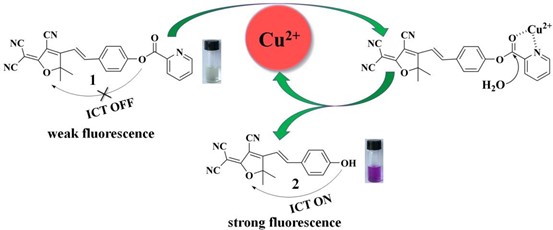 Scheme 2. Proposed sensing mechanism of probe 1 for Cu2+.
Scheme 2. Proposed sensing mechanism of probe 1 for Cu2+.
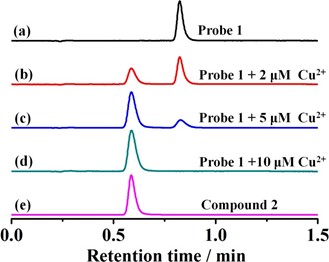
Fig. 5. Reversed-phase HPLC chromatograms of (a) probe 1 (10 μM), (b) probe 1 (10 μM) and Cu2+ (2 μM), (c) probe 1 (10 μM) and Cu2+ (5 μM), (d) probe 1 (10 μM) and Cu2+ (10 μM), (e) compound 2. Detailed chromatographic conditions can be seen in the experimental section.
3.4. Hình ảnh tế bào
Để kiểm tra khả năng ứng dụng của đầu dò 1 trong hệ thống sống, đầu dò 1 đã được áp dụng để hình dung Cu2+ trong tế bào sống bằng cách sử dụng hình ảnh hiển vi huỳnh quang. Tế bào Hela được ủ với đầu dò 1 (10 μM), và ủ với đầu dò 1 (10 μM) với Cu2+ (10 μM) trong DMEM ở 37oC, tương ứng. Thời gian ủ được đặt là 1h. Sau khi ủ trong các điều kiện này, các tế bào được rửa sạch bằng PBS và chụp ảnh bằng kính hiển vi huỳnh quang. Tế bào Hela được ủ với riêng đầu dò 1 hầu như không hiển thị huỳnh quang nội bào (Hình 6B). Các tế bào được ủ với mẫu dò 1 và kết quả là với Cu2+ cho thấy huỳnh quang màu đỏ tươi. Ngoài ra, độc tính tế bào của đầu dò 1 đối với các loại tế bào khác nhau đã được kiểm tra bằng xét nghiệm MTT (Hình S6). Tất cả các tế bào được kiểm tra này vẫn ở trong tình trạng tốt khi xử lý với 0−20 μM của đầu dò 1 trong 24h, cho thấy rằng đầu dò có tính tương thích sinh học cao. Các thí nghiệm tế bào này cho thấy rằng đầu dò 1 có khả năng theo dõi Cu2+ trong tế bào sống.

Fig. 6. Fluorescence microscopy images of Hela cells loaded with probe 1 (10 μM ) in the absence (B) and presence (D) of Cu2+ (10 μM). A and C are Bright-field images. Scare bar: 20 μm.
4. KẾT LUẬN
Tóm lại, chúng tôi đã phát triển một đầu dò bật huỳnh quang bước sóng dài cho Cu2+ bằng cách ghép gốc nhận biết của picolinate với fluorophore dựa trên Tricyanofuran. Việc bổ sung Cu2+ một cách đặc biệt có thể dẫn đến sự chuyển dịch lớn màu đỏ trong phổ hấp thụ và tăng cường đáng kể sự phát xạ huỳnh quang của dung dịch đầu dò thông qua quá trình thủy phân tạo ra Cu2+. Đầu dò 1 thể hiện tính chọn lọc cao đối với Cu2+ và giới hạn phát hiện thấp là 54 nM. Hơn nữa, đầu dò cho thấy khả năng tương thích tế bào tuyệt vời và đã được sử dụng thành công để hình dung Cu2+ trong tế bào sống.
[1] Công trình được Tác giả và các cộng sự thực hiện trong khoảng thời gian 2014-2017, được đăng trên Tạp chí SCI Photochemistry and photobiology A của nhà xuất bản Elsevier
TÀI LIỆU THAM KHẢO
https://www.x-mol.com/paper/1234196190895034368?recommendPaper=717
https://www.sciencedirect.com/science/article/abs/pii/S1010603018300674
https://sci-hub.se/10.1016/j.jphotochem.2018.03.023
https://mjl.clarivate.com/search-results
NCV.TS Nguyễn Khắc Hồng


![[Nghiên cứu về thuốc giảm đau] Cơ chế kiểm soát đau](/yhbd.vn/upload/images/2013/01/kiem%20soat%20dau.jpg)































































.png)





