PHÂN TÍCH VÀ ĐÁNH GIÁ HOẠT TÍNH KHÁNG DÒNG TẾ BÀO UNG THƯ PHỔI A549 CỦA HOẠT CHẤT ISOFLAVONES TÁCH CHIẾT TỪ ĐẬU NÀNH LÊN MEN TEMPEH
Vũ Thị Thanh Hằng1, Nguyễn Xuân Vũ1, Ming-Chang Wu2
TÓM TẮT
Tempeh là sản phẩm lên men được làm từ đậu nành – một thực phẩm truyền thống của người Indonesia, giàu dinh dưỡng, an toàn, đặc biệt, tempeh có chứa các hoạt chất sinh học có khả năng chống oxi-hóa và kháng tế bào ung thư. Trong nghiên cứu này, ngoài việc sử dụng nấm mốc Rhizopus theo phương pháp sản xuất tempeh truyền thống, chúng tôi có bổ sung thêm vi khuẩn lactic để tạo sản phẩm tempeh cải tiến. Nghiên cứu cho thấy nấm mốc Rhizopus có khả năng ngăn chặn sự phát triển của vi sinh vật tạp nhiễm trong thực phẩm, đồng thời, chúng lại phát triển tốt cùng với vi khuẩn lactic trong quá trình lên men đậu nành. Với mục đích nghiên cứu sâu hơn về thành phần hoạt chất đóng vai trò tăng cường hoạt tính sinh học trong đậu nành tempeh có bổ sung vi khuẩn lactic, chúng tôi đã tiến hành nghiên cứu tách chiết, phân tích và so sánh đánh giá hoạt tính kháng tế bào ung thư của hoạt chất sinh học isoflavones tách chiết từ các mẫu đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến. Kết quả đã chứng minh, đậu nành lên men tempeh cải tiến có bổ sung vi khuẩn lactic có chứa hàm lượng isoflavones có lợi cao hơn đậu nành tempeh truyền thống và đậu nành chưa lên men; đồng thời ức chế mạnh sự phát triển của dòng tế bào ung thư phổi A549. Bước đầu của nghiên cứu đã tạo tiền đề để phát triển các thực phẩm chức năng có nguồn gốc từ đậu nành.
MỞ ĐẦU
Tempeh là một thực phẩm lên men truyền thống ở Indonesia được làm từ đậu nành – một nguồn nguyên liệu dồi dào, rẻ tiền; bên cạnh đó, sau khi lên men, đậu nành tempeh lại có giá trị dinh dưỡng cao. Tempeh được sản xuất trải qua các bước ngâm, loại bỏ vỏ, nấu chín và lên men với nấm mốc, phổ biến là giống mốc Rhizopus oligosporus (R. oligosporus). Isoflavones là nhóm hoạt chất sinh học quan trọng có trong đậu nành, bao gồm mười hai đồng phân, đó là các dạng aglycones (daidzein, genistein, glycitein), dạng β-glucosides (daidzin, genistin, glycitin), dạng malonyl-β-glucosides và acetyl-β-glucosides. Trong quá trình lên men tempeh truyền thống, R. oligosporus sản xuất enzyme β-glucosidase xúc tác quá trình thủy phân isoflavone glucoside có sẵn trong đậu nành tạo thành dạng aglycones, là dạng hoạt chất isoflavones đặc biệt quan trọng bởi chúng dễ dàng được hấp thụ vào cơ thể con người do trong cấu trúc hóa học không còn liên kết với phân tử đường trong khi dạng glucosides có chứa liên kết với phân tử đường lớn [7]. Theo nghiên cứu của Chien và cộng sự (2006), trong quá trình lên men tempeh, vi khuẩn lactic hỗ trợ nấm mốc R. oligosporus tăng cường sản xuất enzyme β-glucosidase thủy phân dạng β-glucosides giúp chuyển hóa thành aglycones; hơn thế nữa, vi khuẩn lactic còn sản xuất enzyme protease thủy phân đậu nành tạo ra các dạng peptide hoạt hóa có lợi cho cơ thể người.
Ung thư là một trong những nguyên nhân hàng đầu gây tử vong ở người trên toàn thế giới. Có tới hàng triệu người mỗi năm được chẩn đoán bị ung thư và dẫn đến tử vong. Hiệp hội Ung thư quốc gia Mỹ (American Cancer Society) dự đoán 27 triệu bệnh nhân mắc mới và 17,5 triệu ca tử vong do ung thư trên toàn cầu vào năm 2050 [3]. Vì vậy, việc nghiên cứu phát triển các thực phẩm chức năng tự nhiên hỗ trợ chữa bệnh ung thư đang thu hút sự quan tâm rất lớn của nhiều nhà khoa học. Trong đó, đậu nành lên men tempeh có vai trò tiềm năng trong việc phòng ngừa và điều trị các bệnh mãn tính, đặc biệt là ung thư, bệnh tim, bệnh loãng xương và tiền mãn kinh ở phụ nữ [2]. Isoflavones là nhóm hoạt chất chính đóng vai trò quan trọng trong hoạt tính sinh học tiềm năng của đậu nành [4]. Để nghiên cứu các hoạt chất tự nhiên có vai trò tăng cường hoạt tính sinh học của đậu nành lên men tempeh, chúng tôi đã tiến hành nghiên cứu “Phân tích và đánh giá hoạt tính kháng dòng tế bào ung thư phổi A549 của hoạt chất isoflavone tách chiết từ đậu nành lên men tempeh”.
ĐỐI TƯỢNG, NỘI DUNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Đối tượng nghiên cứu
- Đậu nành chưa lên men (Đậu nành không biến đổi gen, giống K9 Cao Hùng, Đài Loan).
- Đậu nành tempeh truyền thống lên men với nấm mốc Rhizopus oligosporus.
- Đậu nành tempeh cải tiến đồng nuôi cấy với nấm mốc R. oligosporus và bổ sung vi khuẩn lactic Lactobacilus plantarum (L. plantarum)
.jpg)
Hình 1. Quy trình sản xuất tempeh
Nội dung nghiên cứu
- Tách chiết và phân tích thành phần isoflavones của đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến.
- Xác định khả năng kháng tế bào ung thư phổi A549 của thành phần isoflavone tách chiết từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến.
Phương pháp nghiên cứu
Tách chiết isoflavones từ đậu nành tempeh
Đậu nành chưa lên men, đậu nành tempeh truyền thống, đậu nành tempeh cải tiến đã sấy khô được nghiền bằng máy xay, sau đó thu được dạng bột. Khử chất béo bột đậu nành tempeh bằng n-Hexane. Lấy 5 gam bột (đậu nành chưa lên men, đậu nành tempeh truyền thống, đậu nành tempeh cải tiến) cho vào ống falcon rồi bổ sung 20 mL 80% methanol, hỗn hợp được đảo trộn (12 giờ) qua đêm ở nhiệt độ phòng. Hỗn hợp được ly tâm với tốc độ 11,000 vòng trong 15 phút, sau đó, dịch lỏng được lọc và đem đi phân tích định lượng isoflavone bằng máy HPLC [9].
Phân tích định tính định lượng isoflavones từ đậu nành tempeh
Hàm lượng và thành phần của isoflavone tách chiết từ các mẫu được xác định bằng máy HPLC [9]. Hệ thống HPLC bao gồm một bơm Chromaster 5110, một bơm mẫu tự động Chromaster 5210, một detector array diode Chromaster 5430. Một cột Mightysil RP - 18 GP (4.6 x 250 mm) (Kanto Chemical Co. Inc., Tokyo, Japan) được đặt ở 40oC. Pha động của hệ thống HPLC bao gồm dung dịch A (0,1 % axit acetic trong nước cất) và dung dịch B (0,1% axit acetic trong acetonitrile). Tốc độ dòng chảy là 1 ml/phút và độ hấp thụ được đo ở 254 nm. Hàm lượng isoflavone của các mẫu được tính toán dựa vào đường cong chuẩn xây dựng bằng các nồng độ khác nhau của mẫu chuẩn isoflavone.
Chuẩn bị mẫu isoflavone cho thí nghiệm tế bào
Hợp chất isoflavone tách chiết từ các mẫu bằng methanol, sau đó được sấy khô để thu dạng bột isoflavones. Bột isoflavone được pha loãng với dimethyl sulfoxide (DMSO) với tỷ lệ 10 mg/mL. Trước khi được thử nghiệm trên tế bào, dịch mẫu isoflavone được lọc qua màng lọc 0.22 µm để đảm bảo độ tinh sạch của mẫu.
Nuôi cấy tế bào ung thư phổi A549
Tế bào ung thư phổi A549 (có nguồn gốc từ người) được nuôi cấy trong môi trường Ham’s F12 (F-12K) có bổ sung L-glutamine với 10% fetal bovine serum (FBS) và 1% penicillin-streptomycin. Môi trường F-12K được chuẩn bị bằng cách dùng một hộp bột F-12K và 1,5 gam NaHCO3 hòa tan trong 900 mL nước cất khử trùng, sau đó môi trường lỏng được lọc qua ống lọc hút chân không 0.22 µm với sự hỗ trợ của máy aspirator (DF-750, Doctor’s Friend, Đài Loan). Tế bào nuôi cấy trong thiết bị incubator (NU-4500, Nu Aire, USA) ở 370C với 5% CO2.
Hoạt tính gây độc tế bào ung thư phổi A549 của isoflavone
Dịch tế bào ung thư phổi A549 (200 µl) được thêm vào mỗi giếng của đĩa 96 giếng với mật độ tế bào là 5x104 tế bào/mL. Tế bào A549 được nuôi 48 giờ trong điều kiện incubator ở 37oC và 5% CO2. Dịch isoflavone chiết xuất từ đậu nành chưa lên men, từ đậu nành tempeh truyền thống, đậu nành tempeh cải tiến được thử nghiệm trên tế bào A549 với bốn nồng độ khác nhau (12.5, 25, 50 và 100 µg/mL) trong vòng 24 giờ. Sau đó, các tế bào được nuôi tiếp tục trong điều kiện ở 370C và 5% CO2. Hoạt tính ức chế sự phát triển tế bào ung thư phổi A549 được đánh giá sử dụng phương pháp khử thuốc nhuộm tetrazolium (MTT) tạo thành sản phẩm có màu formazan và hoạt tính được đánh giá bằng cách thêm 10 mL MTT, pha loãng trong nước muối đệm phosphate (PBS) (5mg/mL) và 100 mL dịch tế bào. Sau khi ủ ở 370C trong 4 giờ, 100 ml DMSO được thêm vào đĩa giếng để hòa tan kết tủa formazan, được ủ thêm 10 phút và độ hấp thụ được đo ở 570 nm bằng microplate quang phổ (Biotek, Mỹ). Hoạt tính ức chế 50% sự phát triển của tế bào (IC50) sau đó được xác định. Khả năng sống của tế bào ở mỗi mẫu thử nghiệm được tính toán bằng cách sử dụng công thức sau:
Khả năng sống của tế bào (%) = (độ hấp thụ mẫu) / (độ hấp thụ thang chuẩn) × 100
Phương pháp xác định hình thái tế bào
Tế bào ung thư phổi A549 được nuôi cấy vào từng giếng của đĩa 6 giếng với mật độ tế bào 1x105 cells/mL. Tế bào A549 được nuôi ủ ở nhiệt độ 370C và 5 % CO2 trong 24 giờ. Sau đó, tế bào được ủ 24 giờ tiếp theo với isoflavone tách chiết từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến ở 4 nồng độ khác nhau (12.5, 25, 50 and 100 µg/mL) và đối chứng dương là 1% DMSO. Hình thái tế bào được quan sát bằng kính hiển vi (Olympus CK30-F100, Tokyo, Japan).
KẾT QUẢ VÀ THẢO LUẬN
Xác định hàm lượng Isoflavone
Isoflavone là một hoạt chất quan trọng trong đậu nành. Sau khi lên men, hoạt chất isoflavone (daidzin, genistin, daidzein và genistein) trong đậu nành lên men tempeh đã có sự thay đổi so với đậu nành chưa lên men (Hình 1). Daidzein và genistein có xu hướng tăng lên trong khi daidzin và genistin có xu hướng giảm xuống sau khi quá trình lên men do daidzin và genistin dưới xúc tác của enzyme β-glucosidase chuyển hóa thành Daidzein và genistein.
.jpg)
Hình 1. Kết quả chạy HPLC của mẫu (A) đậu nành chưa lên men, (B) đậu nành tempeh truyền thống, (C) đậu nành tempeh cải tiến (1-daidzin; 2-genistin; 3-daidzein; 4-genitein).
Sắc ký đồ HPLC đặc trưng của đậu nành tempeh truyền thống, đậu nành tempeh cải tiến và đậu nành chưa lên men được trình bày trong hình 1 cho thấy đỉnh đồ thị của nhóm isoflavone β-glucosides (bao gồm daidzin, genistin) trong đậu nành chưa lên men cao hơn so với đồ thị các cùng nhóm trong đậu nành tempeh truyền thống và đậu nành tempeh cải tiến. Trong khi đỉnh các đồ thị của nhóm isoflavones aglycones (bao gồm daidzein, genistein) trong đậu nành chưa lên men thấp hơn so với đồ thị cùng nhóm của đậu nành tempeh truyền thống và cải tiến. Điều này phù hợp với nghiên cứu trước đây của Wang và Murphy (1994) cho rằng các dạng glucoside trong đậu nành là sẵn có và thành phần của isoflavones phụ thuộc vào nhiều yếu tố như kỹ thuật chế biến thực phẩm, địa hình địa lý khu vực trồng đậu nành, thời gian cất giữ và vụ mùa thu hoạch.
Theo bảng 1, kết quả cho thấy rằng, quá trình lên men có ảnh hưởng đến hàm lượng hoạt chất isoflavone trong đậu nành. Genistin và daidzin là các dạng isoflavones β-glucosides, luôn sẵn có trong đậu nành, tuy nhiên dạng này lại có xu hướng giảm xuống trong đậu nành lên men tempeh. Số liệu cho thấy về cơ bản, hàm lượng genistin luôn cao hơn daidzin trong cả đậu nành chưa lên men và đậu nành lên men tempeh. Theo bảng kết quả trong bảng 1, hoạt chất isoflavone aglycone có lợi có trong đậu nành tempeh cải tiến có bổ sung vi khuẩn lactic (L. plantarum) có hàm lượng cao hơn và độ chênh lệch có ý nghĩa so với hàm lượng cùng nhóm chất có trong đậu nành tempeh truyển thống chỉ dùng nấm mốc R. oligosporus.
Các kết quả trong thí nghiệm đã chứng minh rằng sự chuyển hóa mạnh từ isoflavones glucoside sang dạng isoflavones aglycones có lợi là do xúc tác quá trình thủy phân glucoside isoflavone của enzyme ß-glycosidase trong quá trình lên men đậu nành [5]. Theo đó, để hình thành dạng isoflavone aglycones, đậu nành phải được tiếp xúc với một độ ẩm nhất định và phải trải qua quá trình lên men để kích hoạt các enzyme β-glycosidase từ các vi sinh vật sử dụng cho quá trình lên men như vi khuẩn lactic (L. plantarum) và nấm mốc Rhizopus. Hoạt động của β-glycosidase đóng vai trò quan trọng giúp tăng cường hoạt chất sinh học trong đậu nành trong quá trình lên men, bởi isoflavones β-glucosides có thể dễ dàng chuyển đổi sang dạng isoflavones aglycones - một dạng isoflavone có lợi rất được quan tâm do khả năng kìm hãm sự phát triển của tế bào ung thư .
Bảng 1. Thành phần isoflavone (daidzein, genistein, daidzein, genistein) của đậu nành và đậu nành tempeh
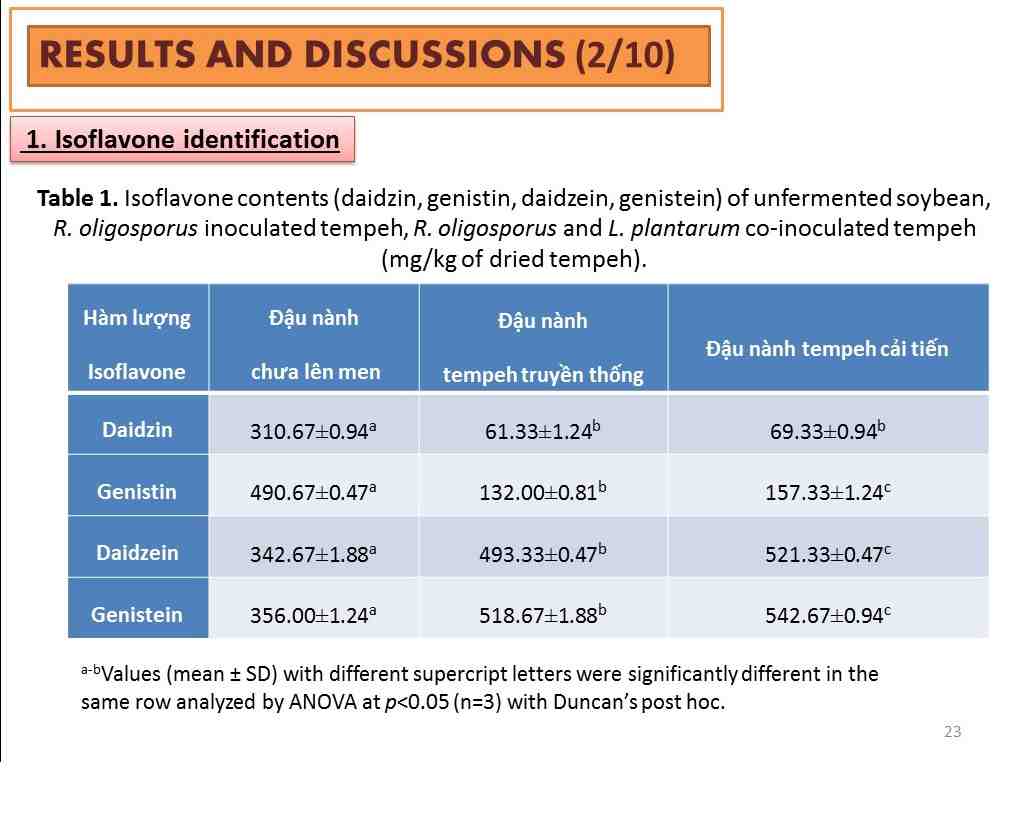
Tác dụng kháng tế bào ung thư phổi A549
Phương pháp xác định hoạt tính gây độc tế bào sử dụng để đánh giá khả năng gây độc tế bào của tác nhân nghiên cứu. Phương pháp này dựa trên hoạt động của enzyme dehydrogenase của ty thể trong các tế bào sống. Tế bào được nuôi trong đĩa 96 giếng. Sau khi ủ 24 giờ, tế bào được xử lý với 2 mẫu chất khác nhau:
- Xử lý với nước chiết thô từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến với 3 nồng độ khác nhau (20, 30, 40 mg/mL) ủ trong 48 giờ.
- Xử lý với hoạt chất isoflavone tách chiết từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh với 4 nồng độ khác nhau (12.5, 25, 50 và 100 µg/mL) ủ trong 24 giờ.
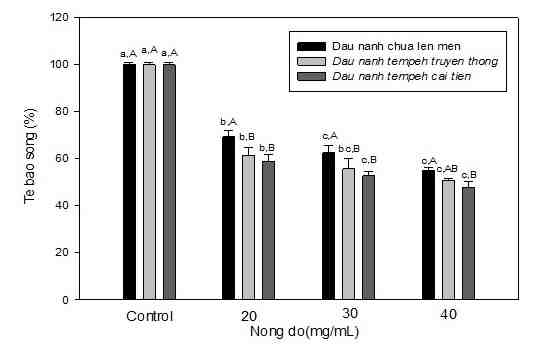
Hình 2: Kết quả xác định hoạt tính gây độc tế bào ung thư phổi A549 của nước chiết thô tách chiết từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành cải tiến ở 3 nồng độ khác nhau (20, 30 và 40 mg/mL) sau 48 giờ ủ mẫu.
Giá trị a-c là độ tin cậy khác nhau trong cùng nhóm mẫu xử lý (đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến). Giá trị A-C là độ tin cậy khác nhau ở cùng nồng độ của mẫu xử lý (20, 30 và 40 mg/mL).
Kết quả cho thấy sau 48 giờ ủ mẫu với tế bào ung thư phổi A549, nước chiết thô tách chiết từ đậu nành tempeh (bao gồm đậu nành truyền thống và đậu nành cải tiến có bổ sung L. plantarum) đã có khả năng tiêu diệt các tế bào ung thư phổi mạnh hơn so với nước thô chiết từ đậu nành chưa lên men. Kết quả IC50 của nước chiết thô từ đậu nành tempeh cải tiến và đậu nành tempeh truyền thống lần lượt là IC50≈36 mg/mL và IC50≈41 mg/mL, IC50 của nước chiết thô từ đậu nành chưa lên men là IC50≈46 mg/mL. Điều này cho thấy nước chiết thô từ đậu nành tempeh cải tiến có khả năng kìm hãm sự phát triển tế bào ung thư hiệu quả nhất. Theo nghiên cứu của nhóm tác giả Kao và Chen (2006), đậu nành lên men tempeh là một nguồn thực phẩm dồi dào chứa hoạt chất quan trọng isoflavones và ngoài ra còn có các hoạt chất chức năng khác như saponin, phenolic; do vậy, tempeh tiềm năng trở thành thực phẩm chức năng hiệu quả trong ngăn chặn sự phát triển của tế bào ung thư. Khi tăng nồng độ xử lý mẫu, tỷ lệ sống của tế bào ung thư giảm đáng kể.
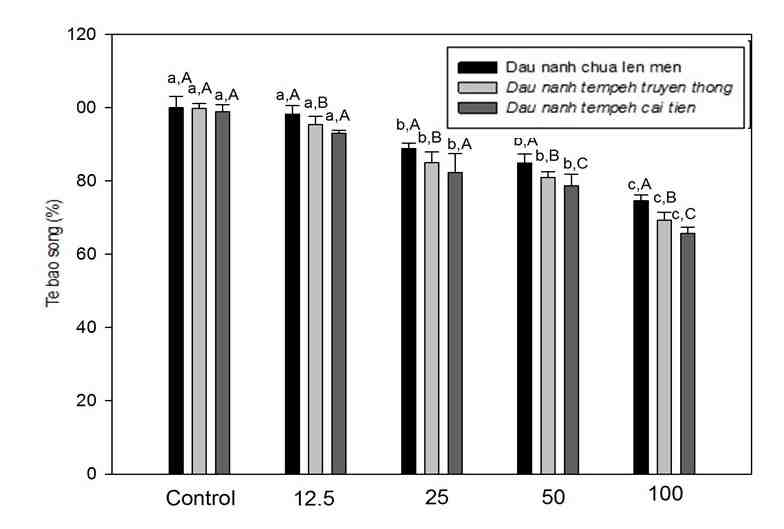
Hình 3: Kết quả xác định hoạt tính gây độc tế bào ung thư phổi A549 của hoạt chất isoflavones tách chiết từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành cải tiến ở 4 nồng độ khác nhau (12.5, 25, 50 và 100 µg/mL) sau 24 giờ ủ mẫu. Giá trị a-c là độ tin cậy khác nhau trong cùng nhóm mẫu xử lý (đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến). Giá trị A-C là độ tin cậy khác nhau ở cùng nồng độ của mẫu xử lý (12.5, 25, 50 và 100 µg/mL).
Khả năng chống tăng sinh của tế bào ung thư của isoflavones tách chiết từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến cũng được đánh giá bằng thử nghiệm gây độc tế bào. Tế bào được ủ trong vòng 24 giờ với các 4 nồng độ khác nhau của isoflavones (12.5, 25, 50 và 100 µg/mL). Kết quả tương tự với thử nghiệm chiết xuất nước thô thử nghiệm trên dòng tế bào A549, isoflavone tách chiết từ đậu nành tempeh cải tiến có tác dụng ức chế rõ rệt sự phát triển của tế bào ung thư, cụ thể, khi tăng nồng độ thử nghiệm của isoflavone thì tỷ lệ sống của tế bào ung thư giảm đáng kể. Tuy nhiên, tại các nồng độ đã thử nghiệm trong nghiên cứu này thì kết quả chưa đạt IC50 (có nghĩa đạt tới nồng độ để có thể ức chế được 50% tế bào ung thư). Xử lý mẫu với nồng độ thấp (5µg/mL) thì hoạt chất isoflavones tách chiết từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến vẫn có khả năng ức chế tế bào ung thư. Kết quả cho thấy isoflavone tách chiết từ đậu nành lên men tempeh cải tiến ức chế tế bào ung thư mạnh hơn isoflavone tách chiết từ đậu nành chưa lên men. Tỷ lệ phần trăm tế bào ung thư sống sót giảm có ý nghĩa với sự tăng nồng độ của isofavone ủ với tế bào. Hiện nay, nhiều nghiên cứu trên thế giới quan tâm đến hoạt tính kháng ung thư của isoflavone từ đậu nành trên các loại bệnh ung thư khác nhau trong cả thử nghiệm in vivo và in vitro.
Hình thái tế bào khi xử lý với isoflavone

Hình 4. Hình thái tế bào A549 sau khi xử lý với isoflavone tách chiết từ đậu nành chưa lên men, đậu nành tempeh truyền thống và đậu nành tempeh cải tiến ở 4 nồng độ khác nhau sau 24 giờ ủ mẫu. (A) 12.5 µg/mL, (B) 25 µg/mL, (C) 50 µg/mL, (D) 100 µg/mL.
Kết quả vể hình thái tế bào ung thư phổi A549 trước và sau khi xử lý với isoflavones ở các nồng độ khác nhau ở hình 4 cho thấy tế bào ung thư có xu hướng co cụm lại khi xử lý với nồng độ tăng cường của isoflavones. Sự co rút của các tế bào ung thư dưới tác động của isoflavones chứng minh rằng hoạt chất isoflavones có tác động làm cho những tế bào ung thư trải qua quá trình phân giải và vỡ ra. Sau đó, tế bào mất khả năng bám dính vào đĩa môi trường nuôi cấy và nổi lên trên môi trường trong đĩa. Bên cạnh sự co cụm, quan sát cho thấy sự giảm rõ rệt về mật độ tế bào ung thư khi xử lý với isoflavones. Để chứng minh isoflavones có khả năng hạn chế sự phát triển của tế bào ung thư phổi A549, nhóm tác giả sẽ tiếp tục nghiên cứu trên động vật thí nghiệm sau này.
KẾT LUẬN
Từ phân tích hàm lượng isoflavones từ các mẫu nghiên cứu, chúng tôi thấy rằng đậu nành tempeh cải tiến có bổ sung vi khuẩn lactic (L. plantarum) có hàm lượng hoạt chất isoflavones aglycones có lợi cao hơn so với hàm lượng cùng nhóm chất có trong đậu nành tempeh truyển thống chỉ dùng nấm mốc R. oligosporus và đậu nành chưa lên men. Điều này chứng tỏ rằng vi khuẩn lactic hỗ trợ nấm mốc R. oligosporus tăng cường sản xuất enzyme β-glucosidase thủy phân dạng β-glucosides giúp chuyển hóa thành aglycones trong quá trình lên men đậu nành. Kết quả thử hoạt tính gây độc tế bào cho thấy hoạt chất isoflavones tách chiết từ đậu nành tempeh cải tiến có hoạt tính mạnh trên dòng tế bào ung thư phổi A549. Tempeh tiềm năng trở thành một thực phẩm chức năng hiệu quả trong ngăn chặn sự phát triển của tế bào ung thư.
TÀI LIỆU THAM KHẢO
1. Chien, H.L., Huang, H.Y. and Chou, C.C., (2006). “Transformation of isoflavone phytoestrogens during the fermentation of soymilk with lactic acid bacteria and bifidobacteria”, Food microbiology, 23(8), pp.772-778.
2. Liu, K.E.S.H.U.N., (2000). “Expanding soybean food utilization”. Food Technology, 54(7), pp.46-59.
3. Mondal S., Bandyopadhyay S., Ghosh MK, Mukhopadhyay S., Roy S., Mandal C. (2012). “Natural Products: Promising Resources for Cancer Drug Discovery”, Anticancer Agents Med. Chem, 12(1), 49-75.
4. Messina, M. and Riaz, M.N., (2006). “Overview of the Health Effects of Soy foods”. Soy
applications in food, pp.23-38.
5. Nakajima, M., Itoh, M., Yamanaka, H., Fukami, T., Tokudome, S., Yamamoto, Y., Yamamoto, H. and Yokoi, T., (2005). “Isoflavones Inhibit Nicotine C‐Oxidation Catalyzed by HumanCYP2A6”. The Journal of Clinical Pharmacology, 46(3), pp.337-344.
6. Kao, T.H. and Chen, B.H., (2006). “Functional components in soybean cake and their effects on antioxidant activity”. Journal of agricultural and food chemistry, 54(20), pp.7544-7555.
7. Rostagno, M.A., Palma, M. and Barroso, C.G., (2004). “Pressurized liquid extraction of isoflavones from soybeans”, Analytica Chimica Acta, 522(2), pp.169-177.
8. Wang, H.J. and Murphy, P.A., (1994). “Isoflavone content in commercial soybean foods”. Journal
of agricultural and food chemistry, 42(8), pp.1666-1673.
9. Yang, S., Wang, L., Yan, Q., Jiang, Z. and Li, L., (2009). “Hydrolysis of soybean isoflavone glycosides by a thermostable β-glucosidase from Paecilomycesthermophila”. Food Chemistry, 115(4), pp.1247-12

![[Nghiên cứu về thuốc giảm đau] Khái niệm về đau](/yhbd.vn/upload/images/2013/01/kiem%20soat%20dau.jpg)