Tóm tắt
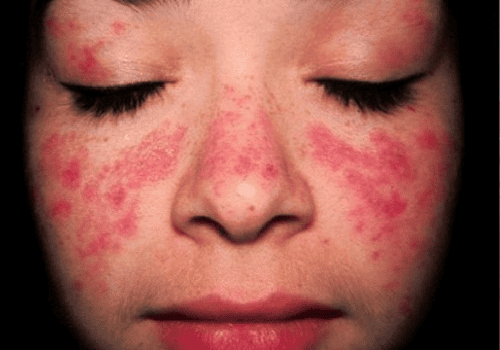
Lupus ban đỏ hệ thống (SLE) là bệnh tự miễn đa cơ quan với phổ tự kháng thể rộng, gây tổn thương da, khớp, thận, máu và thần kinh. Bên cạnh yếu tố di truyền, bằng chứng ngày càng mạnh mẽ cho thấy nhiễm virus, đặc biệt Epstein–Barr virus (EBV), đóng vai trò khởi phát. Một cơ chế trung tâm giải thích sự đa dạng tự kháng thể ở SLE là lan truyền epitope (epitope spreading). Quá trình này bắt đầu từ phản ứng chống kháng nguyên virus, sau đó lan rộng sang tự kháng nguyên của cơ thể khi mô bị tổn thương và các epitope nội sinh bị phơi lộ. Bài viết này tổng hợp bằng chứng dịch tễ, miễn dịch học và phân tử về cơ chế lan truyền epitope trong lupus, đồng thời thảo luận những hàm ý chẩn đoán và điều trị.
Giới thiệu
SLE từ lâu đã được biết đến với tính chất “đa hệ thống” và “đa tự kháng thể”. Bệnh nhân có thể dương tính cùng lúc nhiều loại tự kháng thể: anti-dsDNA, anti-Sm, anti-Ro, anti-La, anti-phospholipid… Điều này đặt ra câu hỏi: làm sao một phản ứng miễn dịch khởi phát lại có thể mở rộng nhanh chóng và bao phủ nhiều mục tiêu như vậy?
Virus và Các Bệnh Tự Miễn Hệ Thống mô tả: “Thông qua cơ chế lan truyền epitope, phản ứng miễn dịch tiếp tục mở rộng để tấn công các tự kháng nguyên khác không liên quan đến EBV, dẫn đến sự đa dạng của các tự kháng thể và bản chất đa hệ thống của bệnh Lupus”. Đây là một giải thích then chốt cho đặc trưng bệnh học của SLE.
Bằng chứng dịch tễ và miễn dịch học
Các nghiên cứu cho thấy bệnh nhân SLE gần như luôn có phơi nhiễm EBV trước đó. Kháng thể chống EBNA-1, một protein nhân của EBV, xuất hiện sớm trong huyết thanh bệnh nhân lupus. Arbuckle và cộng sự (NEJM, 2003) đã chứng minh rằng trong mẫu huyết thanh lưu trữ trước khi bệnh nhân phát triển SLE lâm sàng, kháng thể kháng EBV xuất hiện đầu tiên, sau đó nhiều năm mới xuất hiện các tự kháng thể lupus như anti-dsDNA. Điều này cho thấy phản ứng chống virus có thể là “điểm nổ” ban đầu.
Cùng thời gian, nhiều nghiên cứu cho thấy bệnh nhân lupus có tải lượng EBV cao hơn và đáp ứng miễn dịch chống virus kém hơn người khỏe mạnh. Như vậy, môi trường thuận lợi để virus tái hoạt nhiều lần, tạo ra các vòng viêm mạn tính và tổn thương mô. Chính tổn thương này là tiền đề cho lan truyền epitope.
Cơ chế lan truyền epitope
Khái niệm lan truyền epitope được mô tả trong Cơ Chế Gây Bệnh Cốt Lõi của Virus như một “thác nước tự miễn mở rộng”: “Tổn thương mô ban đầu do phản ứng tự miễn gây ra sẽ làm giải phóng các tự kháng nguyên ‘tiềm ẩn’. Hệ miễn dịch, vốn đã được ‘mồi’ để chống lại ‘bản thân’, giờ đây nhận diện các tự kháng nguyên mới này và khởi động một phản ứng chống lại chúng”.
Trong lupus, cơ chế này diễn ra ở nhiều mức:
- Tại nhân tế bào: ban đầu kháng thể nhắm EBNA-1, nhưng sau tổn thương mô, các protein nhân như Sm, RNP, Ro, La bị giải phóng. Hệ miễn dịch đã được kích hoạt nhận diện chúng, tạo thành chuỗi tự kháng thể mới.
- Tại DNA: tổn thương tế bào chết rơi vãi DNA ngoại bào. Hệ miễn dịch đã quen phản ứng quá mức với kháng nguyên nhân, giờ nhắm cả vào dsDNA, dẫn tới hình thành anti-dsDNA – dấu ấn đặc trưng của lupus.
- Tại màng tế bào và phospholipid: viêm mạn tính làm phơi lộ phospholipid màng, từ đó hình thành kháng thể kháng phospholipid, liên quan trực tiếp đến biến chứng huyết khối ở lupus.
Cơ chế này lý giải vì sao phổ tự kháng thể ở lupus liên tục mở rộng theo thời gian.
Mô hình thực nghiệm
Mô hình động vật củng cố giả thuyết lan truyền epitope. Ở chuột, tiêm một peptide EBV có thể dẫn đến sự xuất hiện không chỉ kháng thể kháng EBV mà cả kháng thể kháng Ro và Sm. Các thí nghiệm in vitro cũng cho thấy kháng thể chống EBNA-1 có khả năng phản ứng chéo với nhiều tự kháng nguyên.
Ngoài ra, dữ liệu mô học từ bệnh nhân lupus cho thấy sự hiện diện của phức hợp miễn dịch tại nhiều mô khác nhau, chứng minh phản ứng không còn giới hạn ở mục tiêu ban đầu.
Thảo luận
Lan truyền epitope mang ý nghĩa giải thích nhiều đặc điểm lâm sàng của lupus. Trước hết, nó giải thích tính chất đa hệ thống: chỉ cần phản ứng khởi phát tại nhân, qua thời gian phản ứng mở rộng tới DNA, màng tế bào, phospholipid, dẫn tới biểu hiện đa dạng. Thứ hai, nó giải thích tính tiến triển mạn tính: bệnh nhân càng lâu năm, phổ tự kháng thể càng rộng, bệnh càng phức tạp. Thứ ba, nó lý giải sự khó khăn trong điều trị: việc ức chế một mục tiêu miễn dịch không đủ, vì phản ứng đã mở rộng quá nhiều.
Tuy nhiên, vẫn còn giới hạn. Không phải mọi bệnh nhân lupus đều có cùng trình tự lan truyền. Một số có anti-dsDNA sớm, số khác lại khởi đầu với anti-Ro. Điều này gợi ý rằng ngoài EBV, còn có các tác nhân khác (UV, thuốc, hormon) có thể đóng vai trò khởi phát. Dù vậy, mô hình EBV–EBNA-1 vẫn là minh họa điển hình và dễ hiểu nhất.
Về mặt can thiệp, lan truyền epitope đặt ra thách thức lớn. Một khi phản ứng đã mở rộng, khó có thể quay ngược. Do đó, can thiệp lý tưởng là chặn phản ứng sớm, trước khi phổ tự kháng thể lan rộng. Điều này gợi ý rằng theo dõi kháng thể kháng EBV hoặc dấu ấn tái hoạt virus có thể giúp dự đoán bệnh lupus sớm. Trong tương lai, vaccine EBV hoặc thuốc kháng virus có thể là một chiến lược dự phòng.
Kết luận
Lan truyền epitope là cơ chế trọng tâm giải thích vì sao lupus lại có phổ tự kháng thể rộng và biểu hiện đa cơ quan. Khởi đầu từ phản ứng chống EBV–EBNA-1, hệ miễn dịch nhầm lẫn và phản ứng chéo, sau đó lan rộng sang nhiều tự kháng nguyên khác khi mô bị tổn thương. Quá trình này làm lupus trở thành một bệnh mạn tính khó kiểm soát, nơi phản ứng miễn dịch luôn tìm ra mục tiêu mới. Hiểu rõ cơ chế này giúp chúng ta lý giải bệnh học và hướng tới chiến lược dự phòng sớm – ngăn lan truyền epitope ngay từ khởi điểm.
Bác sĩ Hoàng Sầm & Hoàng Đôn Hoà.
Tài liệu tham khảo
-
Virus và Các Bệnh Tự Miễn Hệ Thống, Chương 1: Lupus và EBV, 2023.
-
Cơ Chế Gây Bệnh Cốt Lõi của Virus, Chương 2: Lan truyền epitope, 2023.
-
Arbuckle MR et al. Development of autoantibodies before the clinical onset of systemic lupus erythematosus. N Engl J Med. 2003;349(16):1526–33.
-
Poole BD et al. EBV nuclear antigen 1 peptides cross-react with autoantigens in SLE. J Exp Med. 2006;203(12):2887–94.
-
James JA, Robertson JM. Lupus and Epstein–Barr virus: a new perspective. Curr Opin Rheumatol. 2012;24(4):383–388.
-
Tsokos GC. Autoimmunity and organ damage in SLE: the role of epitope spreading. Nat Rev Rheumatol. 2011;7(2):85–90.