By Bác sĩ Hoàng Sầm (Phản biện bài báo theo số 0977356913)
Trong y học, “điều trị chuẩn” thường được coi là kim chỉ nam, nhưng cũng cần thẳng thắn nhìn nhận rằng: mọi chuẩn mực lâm sàng đều do con người xây dựng, dựa trên hiểu biết khoa học của từng giai đoạn. Khi hiểu biết thay đổi, chuẩn mực cần được cập nhật, ung thư học hôm nay đang đứng trước một thực tế như vậy.
Trong nhiều năm, chiến lược điều trị ung thư chủ yếu xoay quanh khối u nguyên phát, phẫu thuật cắt bỏ, hóa trị và xạ trị để tiêu diệt tế bào đang phân chia nhanh, thuốc nhắm trúng đích và miễn dịch để can thiệp vào các tín hiệu sinh học then chốt. Những phương pháp này là nền tảng không thể thay thế, tuy nhiên, thực hành lâm sàng cho thấy một nghịch lý quen thuộc: nhiều bệnh nhân được điều trị đúng phác đồ, khối u được kiểm soát tốt, thậm chí hình ảnh học “sạch tổn thương”, marker sinh học cũng “sạch” nhưng sau một thời gian bệnh vẫn tái phát và thường ở giai đoạn nặng hơn.
Ung thư đã “nặng lên” bằng cách nào?
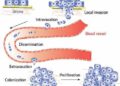
Câu trả lời ngày càng rõ ràng: ung thư tăng giai đoạn chủ yếu là do di căn, chứ không phải do khối u tại chỗ lớn thêm. Trong phân loại giai đoạn, chỉ cần xuất hiện di căn hạch hoặc di căn xa, giai đoạn bệnh lập tức thay đổi, tiên lượng sống giảm rõ rệt. Điều quyết định không còn là kích thước khối u, mà là khả năng di cư và làm tổ mới của tế bào ung thư, tuy nhiên, cần làm rõ một điểm rất quan trọng nhưng thường bị bỏ qua: không phải bất kỳ tế bào ung thư nào đi ra khỏi khối u cũng có thể tạo thành ổ di căn. Trên thực tế, đại đa số tế bào ung thư rời khỏi khối u sẽ chết dọc đường, bị hệ miễn dịch tiêu diệt hoặc không thích nghi được với môi trường mới. Di căn thành công là một hiện tượng hiếm, có chọn lọc, và ngày càng có nhiều bằng chứng cho thấy chỉ một nhóm đặc biệt – tế bào gốc ung thư (Cancer Stem Cells, CSC) – mới thực sự đóng vai trò quyết định.
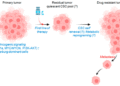
CSC là một quần thể nhỏ trong khối u, nhưng có những đặc tính rất nguy hiểm: khả năng tự làm mới, khả năng chịu đựng stress cao, kháng hóa trị và xạ trị, và quan trọng nhất là khả năng “làm tổ” ở môi trường mới. Khi khối u phát tán tế bào ra ngoài, phần lớn tế bào thông thường chỉ là “quân lính đánh thuê”, đi được nhưng không sống được. Ngược lại, CSC giống như “hạt giống”, chỉ cần rơi vào mảnh đất phù hợp là có thể nảy mầm, tái tạo cả một khối u mới. Vì vậy, di căn thành công về bản chất là di căn do CSC. Điều này lý giải vì sao nhiều phác đồ điều trị có thể làm khối u co nhỏ rất tốt, nhưng vẫn không ngăn được tái phát và di căn xa. Hóa trị và xạ trị chủ yếu tiêu diệt các tế bào đang phân chia mạnh, trong khi CSC thường ở trạng thái chậm phân chia hoặc “ngủ”, ít nhạy cảm với các tác nhân này. Khi điều trị kết thúc, chính những CSC còn sót lại có thể trở thành nguồn gốc của di căn và tái phát.
Từ góc nhìn đó, một khoảng trống chiến lược hiện ra rất rõ, trong thực hành ung thư hiện nay, chúng ta hiếm khi đặt câu hỏi: làm thế nào để ngăn CSC di cư, sống sót và làm tổ? Chiến lược chống di căn thường chỉ được triển khai khi di căn đã xuất hiện, trong khi CSC đã âm thầm tồn tại và hoạt động từ rất sớm, thậm chí trước cả khi chẩn đoán. Vì vậy, đã đến lúc cần thay đổi tư duy: chiến lược chống di căn – và cụ thể hơn, chống CSC – cần được đưa vào ngay từ khi tiếp nhận bệnh nhân ung thư. Điều này không đi ngược lại điều trị chuẩn, mà bổ sung vào đúng điểm còn thiếu. Điều trị khối u là cần thiết, nhưng ngăn không cho “hạt giống ung thư” bén rễ mới là yếu tố quyết định lâu dài.
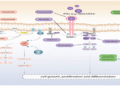
Trong bối cảnh đó, một số thảo dược cổ truyền, khi được nghiên cứu bằng sinh học hiện đại, cho thấy những tác động rất đáng chú ý lên CSC và các bước then chốt của quá trình di căn. Curcumin từ nghệ đã được chứng minh có thể ức chế các đường tín hiệu duy trì CSC như Wnt/β-catenin, Notch và Hedgehog, đồng thời làm giảm EMT – điều kiện cần để CSC rời khỏi khối u. EGCG từ trà xanh cho thấy khả năng ức chế quần thể CSC ở nhiều loại ung thư, làm giảm khả năng tạo khối cầu và làm tổ. Berberin và polydatin từ hổ trượng căn không chỉ đảo chiều EMT mà còn làm giảm “tính gốc” của tế bào ung thư. Shikonin và celastrol, với hoạt tính rất mạnh trên nhiều dòng ung thư, được ghi nhận có khả năng tác động chọn lọc lên các tế bào ung thư có đặc tính giống CSC, dù việc sử dụng cần hết sức thận trọng và có kiểm soát chặt chẽ.
Điều quan trọng là: những thảo dược này không nhằm thay thế hóa trị, xạ trị hay thuốc nhắm đích. Vai trò hợp lý của chúng là hỗ trợ chiến lược, tạo ra một môi trường bất lợi cho CSC: làm chúng khó rời khối u, khó sống sót khi di cư và khó làm tổ ở cơ quan xa. Nếu phải diễn giải cho người bệnh một cách giản dị, có thể nói rằng điều trị ung thư không chỉ là “đánh vào cái u”, mà còn là không cho hạt giống ung thư có cơ hội mọc ở nơi khác.
“Điều trị chuẩn” không phải là bất biến. Khi khoa học đã chỉ ra rằng di căn – và sâu xa hơn là CSC – mới là yếu tố quyết định giai đoạn và tiên lượng, thì việc đưa chiến lược chống CSC vào trung tâm ngay từ đầu điều trị không phải là đi chệch chuẩn, mà là đi trước một bước cần thiết. Một nền y học nhân văn không chỉ chữa cái đang thấy, mà còn chủ động ngăn cái sắp xảy ra. Và trong chiến lược đó, sự kết hợp tỉnh táo giữa y học hiện đại và thảo dược dựa trên bằng chứng khoa học có thể mở ra một hướng điều trị sâu sắc và bền vững hơn cho người bệnh ung thư.
Chú ý: chỉ những tế bào gốc ung thư đủ sức sống sót, ngủ đông, và tự tái tạo, tự nhân lên vô hạn mới gây di căn thực sự thành công.
Tài liệu tham khảo
- Hanahan D, Weinberg RA. Hallmarks of Cancer: The Next Generation. Cell, 2011.
- Lambert AW et al. Emerging biological principles of metastasis. Cell, 2017.
- Gupta GP, Massagué J. Cancer metastasis: building a framework. Cell, 2006.
- Thiery JP et al. Epithelial–mesenchymal transitions in cancer. Cell, 2009.
- Batlle E, Clevers H. Cancer stem cells revisited. Nature Medicine, 2017.
- Phi LTH et al. Cancer stem cells and metastasis. Clinical & Translational Medicine, 2018.
- Shanmugam MK et al. Curcumin and cancer stem cells. Cancer Letters.
- Tang SN et al. EGCG targets cancer stem-like cells. Carcinogenesis.
- Zhou Y et al. Celastrol targets cancer stemness pathways. Molecular Cancer.