Tác giả Piyush Kumar Gupta,*,Mrunmayee Saraff,Rekha Gahtori,Nidhi Negi,Surya Kant Tripathi,Jatin Kumar,Sanjay Kumar,Saad Hamad Aldhayan,Sugapriya Dhanasekaran,Mosleh Mohammad Abomughaid ,Kamal Dua 8,Rohit Gundamaraju ,Shreesh Ojha 10,Janne Ruokolainen ,Niraj Kumar Jha andKavindra Kumar Kesari ,*
Biên dịch: Hoàng Đôn Hòa | Viện Y học bản địa Việt Nam
Mục lục:
- Các chất phytomedicines nhắm vào các yếu tố chính gây kháng thuốc chống ung thư ở CSCs
- Các chất phytomedicines nhắm vào các đường truyền tín hiệu Wnt/β-Catenin, Notch, và Hedgehog trong CSCs
- Các nghiên cứu lâm sàng về phytomedicines
Các chất phytomedicines nhắm vào các yếu tố chính gây kháng thuốc chống ung thư ở CSCs
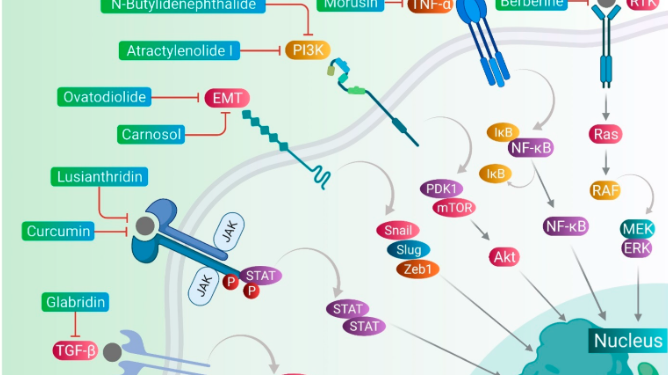
Các tế bào gốc ung thư (CSCs) góp phần vào khả năng kháng thuốc chống ung thư thông qua nhiều cơ chế, bao gồm điều hòa EMT, tăng cường biểu hiện của các chất vận chuyển ABC, biểu hiện quá mức của enzyme aldehyde dehydrogenase (ALDH), chu kỳ chậm của microRNA, điều hòa vi môi trường khối u, cũng như khả năng chống lại tổn thương DNA và chết tế bào. Các chất phytomedicines nhắm vào bất kỳ một trong những bộ máy điều hòa chính này trong khả năng kháng thuốc của CSCs đối với các thuốc chống ung thư (Hình 2). Việc nhắm mục tiêu vào các cơ chế này có thể quan trọng trong việc ngừng hoặc loại bỏ CSCs và có thể cải thiện kết quả của thuốc chống ung thư trong quá trình hóa trị ung thư. Một số phytomedicines này được thảo luận trong phần này và thông tin liên quan cũng như hình ảnh của chúng được cung cấp trong Hình 3 và được tóm tắt trong Bảng 2.
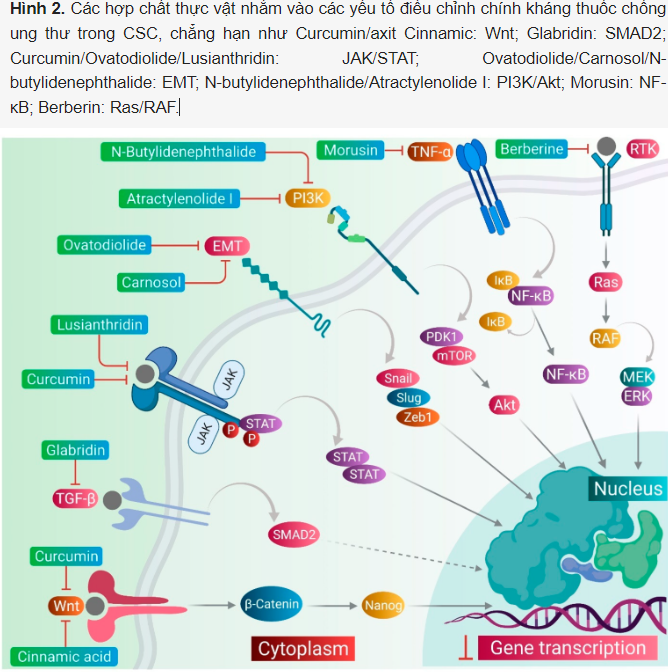
Hình 3. Các hợp chất thực vật nhắm vào các cơ quan quản lý chính khác nhau về tình trạng kháng thuốc chống ung thư trong CSC.
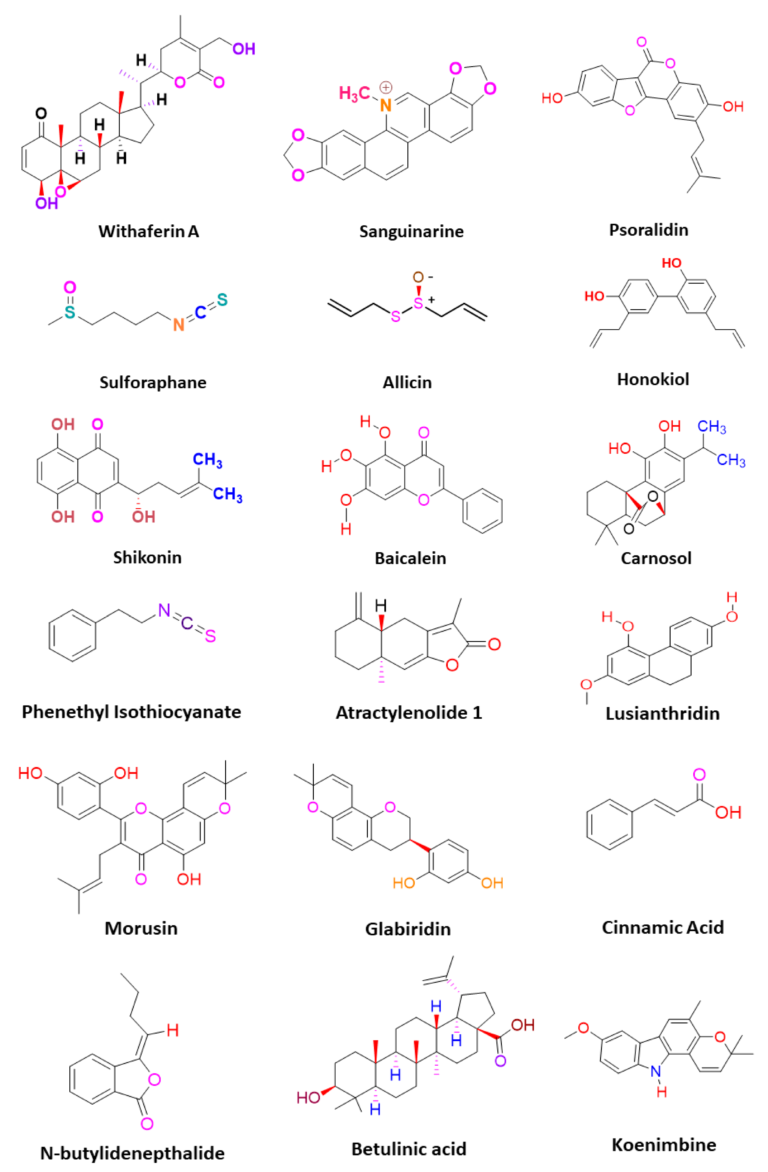
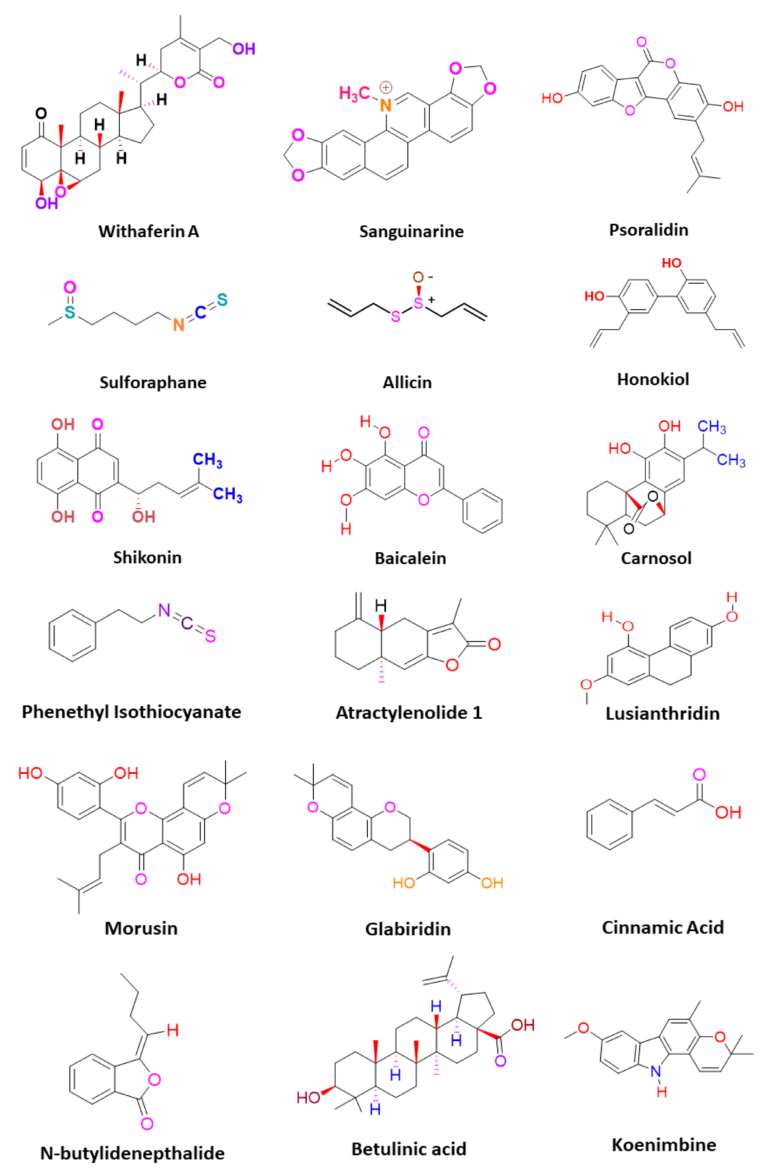
Bảng 2. Các hợp chất thực vật nhắm vào các yếu tố điều chỉnh chính về tình trạng kháng thuốc chống ung thư trong CSC.
|
Nguồn thực vật |
Trích xuất |
Hợp chất hoạt tính sinh học |
Liều lượng trong Vivo |
||
|---|---|---|---|---|---|
| Học giả Alstonia | Chiết xuất trái cây | Học giả Q(1) và R(2) | —— | ||
| Anisoles indica | —— | Ovatodiolide | —— | ||
| Cảm ứng apoptosisĐiều chỉnh giảm Sox2 và Oct4Tăng E-cadherinRối loạn điều hòa con đường JAK2/STAT3 | —— | Dân số CSC trong ung thư biểu mô vòm họng | |||
| Cảm ứng apoptosisĐiều chỉnh giảm CD133, Klf4, Oct4, Nanog và JARID1BRối loạn điều hòa con đường JAK2/STAT3 | 3,6 mg/kg | CSC uống và chuột khối u xenograft | |||
| Rau cải |
—— | Phenetyl isothiocyanat | 20 mg/kg | ||
| Thúc đẩy căng thẳng oxy hóaỨc chế yếu tố phiên mã Sp1 | 10 µM | CSC cổ tử cung và chuột khối u Xenograft NOD-SCID | |||
| Atractylodes macrocephala Koidz | Chiết xuất thân rễ | Atractylenolide tôi | 25 mg/kg và 75 mg/kg | ||
| Fructus viticis | —— | Flavonoid | —— | ||
| Đậu bồ câu | —— | Dẫn xuất axit Cajaninstilbene | —— | ||
| Berberis libanotica Ehrenb | Chiết xuất rễ | —— | —— | ||
| Berberis , Arcangelisia Hydrastis | —— | Berberin | —— | ||
| Dendrobium venustum |
Chiết xuất thân cây | Lusianthridin | —— | ||
| Curcuma longa | —— | tinh bột nghệ | —— | ||
| —— | tinh bột nghệ | Giảm biểu hiện của các chất vận chuyển ABC ABCG2 và ABCC1 | CSC vú | ||
| —— | tinh bột nghệ | Cảm ứng apoptosisRối loạn điều hòa đường truyền tín hiệu JAK/STAT3 | CSC tuyến giáp dạng nhú | ||
| —— | tinh bột nghệ | Cảm ứng apoptosis | Tế bào gốc glioblastoma và chuột khối u xenograft | ||
| Walsura pinnata Hassk | Chiết xuất vỏ cây | Axit betulonic | 18, 36 hoặc 54 μM | ||
| chi phí đặc biệt | Chiết xuất thân rễ | —— | —— | ||
| Violaodorata | Chiết xuất hydro-cồn của phần trên không | —— | —— | ||
| Đa giác cuspidatum | Chiết xuất rễ | 2-Ethoxystypandrone | —— | ||
| quế quế | —— | Axit cinnamic | —— | ||
| Cam thảo | —— | Glabridin | 20 mg/kg | ||
| Morus australis | —— | Morusin | —— | ||
| Lithospermum erythrorhizon | —— | Shikonin | 2 mg/kg | ||
| Rosmarinus officinalis | —— | Carnosol | —— | ||
| Piên Tử Hoàng | —— | —— | —— | ||
| cây tỏi | —— | Allicin (dialyl thiosulfinate) | —— |
Curcumin, một polyphenol chiết xuất từ củ nghệ (Curcuma longa), một thành phần phổ biến trong chế độ ăn uống, là một trong những chất tự nhiên được nghiên cứu nhiều và đánh giá cao về nhiều đặc tính sinh học, bao gồm khả năng chống ung thư mạnh mẽ, khả năng phòng ngừa hóa trị và nhạy cảm hóa trị, và lợi ích trong việc hiệp đồng hoạt động chống ung thư và giảm độc tính hạn chế liều lượng cho các cơ quan. Gần đây, nhiều báo cáo đã tiết lộ rằng curcumin nhắm mục tiêu vào CSCs trong ung thư vú, tuyến giáp và não. Curcumin đã được chứng minh là hoạt động theo nhiều cách và dường như là một tác nhân đa dược lý trong việc điều chỉnh nhiều con đường truyền tín hiệu và các yếu tố phiên mã. Tất cả những cơ chế này cuối cùng hội tụ để giảm tế bào khối u. Trong một nghiên cứu, curcumin làm giảm các dấu hiệu EMT (vimentin, fibronectin, β-catenin) và các dấu hiệu gốc (Sox2, Nanog, Oct4). Trong một nghiên cứu khác, nó làm giảm sự biểu hiện quá mức của các chất vận chuyển ABC trong CSCs vú. Trong CSCs tuyến giáp thể nhú, CUR đã làm rối loạn con đường truyền tín hiệu JAK/STAT3. Một trong những rào cản chính trong phát triển dược phẩm của curcumin là khả dụng sinh học của nó. Do đó, để đạt được sự ổn định tốt hơn, độ tan tốt trong nước và khả dụng sinh học của CUR, nhiều hệ thống phân phối thuốc mới đã được phát triển và đang được đánh giá thêm. Tương ứng, curcumin liposomal cho thấy khả năng thẩm thấu tăng cường và hiệu quả điều trị chống ung thư mạnh mẽ đối với các bệnh ung thư kháng thuốc khác nhau, bao gồm cả u nguyên bào thần kinh đệm. Tiếp theo, Ovatodiolide (Ova) là một diterpenoid macrocyclic, được phân lập từ Anisomeles indica. Nó thể hiện tác dụng chống ung thư mạnh mẽ trên các tế bào ung thư nguyên bào thần kinh đệm, ung thư vòm họng và ung thư miệng. Về mặt cơ chế, Ova làm giảm các dấu hiệu gốc (CD44, CD133, Sox2, Klf4, Nanog và Oct4) của CSCs và giảm biểu hiện của các gen EMT. Nó cũng điều chỉnh con đường truyền tín hiệu JAK2/STAT3 bằng cách ức chế protein JAK2 hoặc STAT3, và do đó làm rối loạn quá trình phiên mã gen. Ngoài ra, Ova gây ra cái chết tế bào theo chương trình và gây độc tế bào đối với các tế bào ung thư. Các phát hiện đã được chuyển thành một nghiên cứu in vivo, trong mô hình chuột ung thư miệng (tế bào SAS), trong đó Ova (3,6 mg/kg) làm giảm sự phát triển của khối u, ít hơn 2,2 lần so với những con chuột không được điều trị.
Lusianthridin, một dẫn xuất phenanthrene và hợp chất phenolic được phân lập từ thân cây Dendrobium venustum, đã được chứng minh là làm giảm con đường truyền tín hiệu Src-STAT3-c-Myc và ức chế các dấu hiệu gốc CD133, ABCG2 và ALDH1A1, gây ra quá trình apoptosis trong CSCs phổi. Chiết xuất rễ của Polygonum cuspidatum bao gồm 2-ethoxystypandrone, một chất tương tự mới của juglone, đã được chứng minh là ức chế con đường truyền tín hiệu STAT3 trong các tế bào ung thư biểu mô tế bào gan (HCC). Nó ngừng tăng trưởng và tăng sinh của các tế bào HCC theo cách phụ thuộc liều và gây ra quá trình chết theo chương trình của CSCs trong HCC.
Mặc dù phần lớn các phytomedicines đã được chứng minh là nhắm vào con đường chết tế bào hoặc apoptosis, một số ít trong số chúng cũng được chứng minh là nhắm vào việc bắt giữ chu kỳ tế bào, chẳng hạn như hai alkaloid indole monoterpenoid, Scholarisine Q (1) và R (2), được phân lập từ chiết xuất trái cây của Alstonia scholaris, được phát hiện là gây ra quá trình apoptosis trong các tế bào gốc u thần kinh đệm. Một phytoconstituent khác, berberine, một hợp chất alkaloid isoquinoline có nhiều trong cây Berberis vulgaris, đã được phát hiện là có hiệu quả trong việc giảm khả năng gốc, di chuyển tế bào và tăng trưởng tế bào (thông qua việc bắt giữ chu kỳ tế bào G0-G1) của các tế bào thần kinh đệm và CSCs tuyến tiền liệt, tương ứng. Tương tự, chiết xuất của Viola odorata giàu nhiều thành phần hoạt tính sinh học, chẳng hạn như saponin, dẫn xuất axit salicylic, glycosides, alkaloids, anthocyanidins và cyclotides, đã được chứng minh là gây ra quá trình apoptosis và làm giảm sự tăng trưởng và di chuyển của CSCs vú.
Carnosol, một diterpene polyphenolic có nhiều trong Rosmarinus officinalis, cho thấy sự điều chỉnh các gen EMT và gây ra apoptosis trong CSCs u nguyên bào thần kinh đệm . Phenethyl isothiocyanate (PEITC), một isothiocyanate tự nhiên chủ yếu có trong các loại rau họ cải như bông cải xanh và cải xoong, đã được chứng minh là làm tăng stress oxy hóa trong CSCs và điều chỉnh giảm biểu hiện của các gen gốc trong các bệnh ung thư khác nhau, chẳng hạn như ung thư cổ tử cung và ung thư ruột kết. Trong một nghiên cứu in vivo sử dụng mô hình chuột NOD-SCID được ghép xenograft ALDH+ HeLa CSCs, PEITC ở nồng độ 10 μM cho thấy sự giảm thể tích khối u khi so sánh với những con chuột không được điều trị làm chuột đối chứng. Trong một nghiên cứu khác, PEITC ở liều 20 mg/kg đã ức chế sự tăng trưởng của EpCAM+ CSCs được phân lập từ tế bào ung thư HCT116 và cũng cho thấy sự giảm tăng trưởng khối u của mô hình chuột ung thư ruột kết được tiêm EpCAM+ CSCs. Atractylenolide-1 (ATL-1) là một sesquiterpene được phân lập từ chiết xuất thân rễ của Atractylodes macrocephala Koidz, một loại thảo dược phổ biến của Trung Quốc. ATL-1 (25–75 mg/kg) đã điều chỉnh giảm con đường Akt/mTOR và thay đổi quá trình chuyển hóa glucose và hành vi giống tế bào gốc trong các tế bào ung thư ruột kết. Nó cũng ức chế sự tiến triển của khối u đại trực tràng ở những con chuột khỏa thân được ghép xenograft. Các phân đoạn polyphenolic tổng số thu được từ Fructus viticis đã được chứng minh là điều chỉnh con đường Akt/mTOR và kìm hãm các đặc tính gốc trong CSCs phổi.
Axit Cinnamic, một axit monocarboxylic được phân lập từ vỏ cây quế (Cinnamomum zeylanicum), đã được chứng minh là làm giảm khả năng gốc của CSCs ruột kết. Shikonin, một dẫn xuất naphthoquinone có nhiều trong rễ của một loại thảo dược Trung Quốc, Lithospermum erythrorhizon, đã điều chỉnh con đường JNK/c-Jun và tăng cường khả năng gây độc tế bào của nó trong các tế bào gốc u nguyên bào thần kinh đệm (GSCs). Các phát hiện quan sát được trong các nghiên cứu in vitro đã được xác nhận trong mô hình chuột được ghép xenograft GSCs. Morusin, một flavonoid có trong rễ của Morus australis, đã được phát hiện là làm suy giảm hoạt động NF-κB trong CSCs cổ tử cung và gây ra quá trình chết tế bào theo chương trình trong các CSCs này bằng cách hạn chế sự di chuyển và tăng trưởng của chúng. Hơn nữa, hợp chất này còn gây độc tế bào đối với CSCs cổ tử cung. Glabridin, một isoflavane thu được từ rễ của Glycyrrhiza glabra, đã điều chỉnh quy định biểu sinh của tín hiệu miR-148a/SMAD2 và ức chế các đặc tính giống tế bào gốc của tế bào ung thư vú ở người. Ngoài ra, Glabridin (20 mg/kg) đã cải thiện sự sống của những con chuột ung thư vú được ghép xenograft. Tương tự, các dẫn xuất axit Cajaninstilbene của đậu bồ câu đã điều chỉnh khả năng gây độc tế bào (con đường chưa được suy luận) trong các tế bào giống tế bào gốc ung thư vú.
Người ta đã báo cáo rằng các gen vận chuyển ABC như ABCG2 và ABCB5 thường bị điều hòa tăng trong các bệnh ung thư tuyến tụy, vú, phổi, buồng trứng và da, và có thể là mục tiêu tiềm năng để điều trị. PienTze Huang (PZH), một loại thuốc y học cổ truyền Trung Quốc (TCM) bao gồm Moschus, Calculus Bovis, Snake Gall và Radix Notoginseng, đã ức chế mức mRNA của các chất vận chuyển ABCB1 và ABCG2 trong các tế bào quần thể phụ HT29 (HT29 CSCs). Nó cũng ức chế sự phát triển của CSCs đại trực tràng theo cách phụ thuộc vào liều.
Tương tự như các hợp chất hoạt tính sinh học có nguồn gốc thực vật, các chiết xuất thực vật đã được thử nghiệm trong nhiều nghiên cứu. Các chiết xuất thô được điều chế từ toàn bộ cây hoặc một số bộ phận nhất định của cây cho thấy tác dụng chống ung thư mạnh mẽ ở nhiều loại ung thư bằng cách nhắm mục tiêu vào CSCs kháng thuốc trong quần thể tế bào của chúng. Ví dụ, chiết xuất vỏ cây của Walsura pinnata Hassk và chiết xuất thân rễ của Costus speciosus đã gây ra quá trình chết tế bào theo chương trình trong các tế bào bạch cầu và CSCs tuyến tiền liệt, tương ứng. Trong các phần tiếp theo, chúng tôi thảo luận toàn diện về việc nhắm mục tiêu vào một số dấu hiệu gốc, gen EMT và các con đường truyền tín hiệu tế bào, có thể là một phương pháp điều trị quan trọng để loại bỏ CSCs khỏi quần thể tế bào ung thư kháng thuốc, cũng như để kiểm tra sự phát triển và tăng sinh của tế bào, do đó ngừng tăng trưởng khối u.
Các chất phytomedicines nhắm vào các đường truyền tín hiệu Wnt/β-Catenin, Notch, và Hedgehog trong CSCs
Như đã thảo luận trước đó, các con đường truyền tín hiệu Wnt, Notch và Hh chịu trách nhiệm cho các đặc tính giống tế bào gốc của tế bào ung thư và giải thích cho khả năng tự làm mới của chúng. Do đó, chúng tôi chủ yếu tập trung vào việc xem xét các phytomedicines đặc biệt nhắm vào các con đường này. Việc nhắm mục tiêu điều trị vào các con đường này bằng phytomedicines có thể mở đường cho việc thiết kế và phát triển các liệu pháp tự nhiên. Các phytomedicines nhắm vào các con đường này được minh họa bằng sơ đồ trong Hình 4.
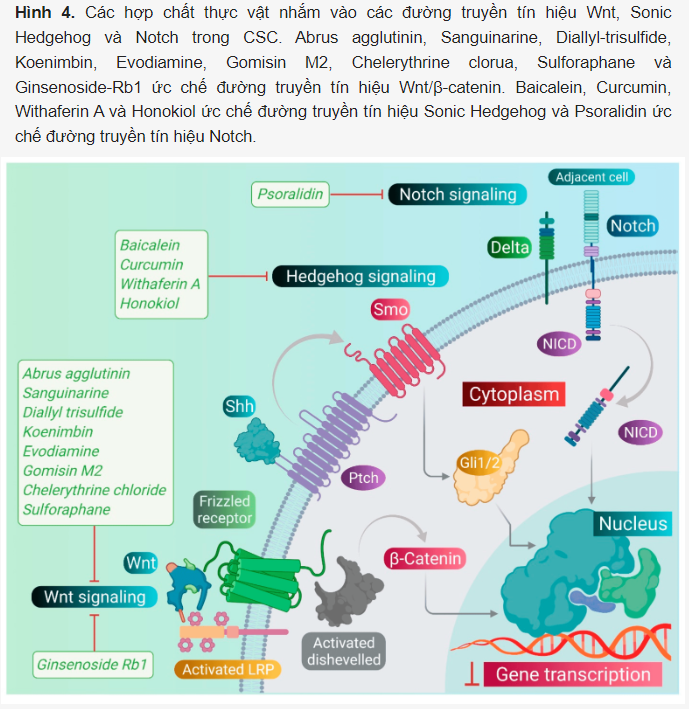
Các chất phytomedicines nhắm vào đường truyền tín hiệu Wnt/β-Catenin
Các chất phytomedicines đã được chứng minh là có khả năng loại bỏ CSCs bằng cách điều chỉnh đường truyền tín hiệu Wnt/β-catenin. Trong một nghiên cứu, diallyl trisulfide, một hợp chất organosulfur chủ yếu có trong tỏi, đã được phát hiện là làm tăng biểu hiện của GSK3-β và làm giảm β-catenin, biểu thị sự ức chế đường truyền Wnt/β-catenin trong CSCs đại trực tràng. Tương tự, Koenimbin, một hợp chất alkaloid được chiết xuất từ lá của Murraya koenigii (L) Spreng, một loại cây thường được gọi là cây cà ri được sử dụng trong các chế phẩm ăn kiêng trên khắp tiểu lục địa Ấn Độ và nổi tiếng về đặc tính dược liệu của nó, đã được phát hiện là làm giảm mức độ biểu hiện của β-catenin và cyclin D1 trong CSCs MCF7. Nó dẫn đến sự hình thành các khối cầu vú bị ức chế và làm giảm quần thể ADH+ MCF7 CSC, làm trung gian điều hòa giảm đường truyền Wnt/β-catenin. Trong một nghiên cứu khác, ginsenoside-Rb1 (Rb1), một saponin triterpenoid tự nhiên được tìm thấy nhiều trong thân rễ của cây Panax quinquefolius và Notoginseng (một loại thuốc thảo dược của Trung Quốc), đã được chứng minh là nhắm mục tiêu vào CSCs buồng trứng, làm trung gian ức chế tín hiệu Wnt/β-catenin con đường cùng với sự đảo ngược của EMT. Một chất chuyển hóa của Ginsenoside-Rb1, được gọi là hợp chất K, kết hợp với Rb1 đã ức chế khả năng tự đổi mới của CSCs buồng trứng (được phân lập từ bệnh nhân) trong mô hình chuột khối u xenograft và làm nhạy cảm các CSCs này đối với tác dụng gây độc tế bào của chúng bằng các tác nhân hóa trị liệu, chẳng hạn như cisplatin và paclitaxel. Abrus agglutinin, một lectin, được phân lập từ hạt của Abrus precatorius, đã điều chỉnh giảm biểu hiện CD44+ trong tế bào FaDu (tế bào ung thư miệng) và ức chế sự phát triển và dẻo của các tế bào FaDu. Hơn nữa, nó ức chế con đường truyền tín hiệu Wnt/β-catenin và ức chế khả năng tự đổi mới của CSCs có nguồn gốc từ FaDu. Hợp chất này cũng gây ra apoptosis trong CSCs FaDu theo cách phụ thuộc vào liều lượng. Các hành động sau đó đã được xác nhận lại ở chuột nude được cấy ghép FaDu, trong đó nó đã ngừng tăng trưởng khối u. Một hợp chất khác, sulforaphane, được phân lập từ các loại rau họ cải như bông cải xanh và bắp cải, đã ức chế sự hình thành của các khối cầu u vòm họng giàu CSCs. Sulforaphane ở liều 60 mg/kg làm giảm sự phát triển khối u trong tế bào C666-1 trong mô hình chuột xenograft thông qua trục DNA methyltransferase 1/Wnt inhibitory factor 1. Nó sở hữu hoạt động chống ung thư mạnh mẽ. Điều trị bằng sulforaphane cũng ức chế sự biểu hiện của miR-19, điều chỉnh trục miR-19/GSK3β/β-catenin và các đặc điểm của CSCs phổi. Nó cũng làm giảm điều hòa đường truyền Wnt/β-catenin và hoạt động phiên mã β-catenin/TCF trong CSCs phổi. Sau khi điều trị bằng sulforaphane, các khối u phổi không phát triển và giảm các dấu hiệu biểu hiện của CSCs phổi. Hơn nữa, Chelerythrine chloride, một alkaloid benzophenanthridine được phân lập từ Chelidonium majus, đã điều chỉnh giảm biểu hiện của Sox2, MYC và β-catenin trong tế bào SK-LU-1 và NCI-H1703. Điều này cho thấy sự ức chế đường truyền Wnt/β-catenin trong các tế bào ung thư phổi làm trung gian điều hòa giảm β-catenin và dẫn đến việc hạn chế các đặc tính của CSC và gây ra apoptosis. Sanguinarine, một alkaloid benzophenanthridine thu được từ cây Chelidonium majus L. (cây hoàng liên gai), làm giảm điều hòa đường truyền tín hiệu Wnt/β-catenin và ức chế sự tăng sinh và xâm lấn của CSCs phổi, do đó gây ra quá trình apoptosis trong CSCs phổi. Gomisin M2, một loại lignan thuộc nhóm tanin có thể thủy phân, cũng tạo thành một thành phần hoạt động của thuốc Baizuan của Trung Quốc, và ức chế sự tăng sinh của tế bào MDA-MB-231 và HCC1806. Ngoài ra, nó còn ức chế khả năng tự đổi mới của CSCs vú bằng cách điều chỉnh giảm đường truyền tín hiệu Wnt/β-catenin. Do đó, nó đã ngăn chặn sự hình thành các khối cầu vú trong CSCs vú và gây ra apoptosis trong CSCs vú bằng cách thay đổi điện thế màng ty thể. Hơn nữa, evodiamine, một alkaloid quinolone tự nhiên được phân lập từ Evodia rutaecarpa, đã ức chế sự tăng sinh của các tế bào ung thư ruột kết được nuôi cấy số lượng lớn và bắt giữ chu kỳ tế bào ở pha G2/M, do đó gây ra apoptosis trong các tế bào này. Hơn nữa, hợp chất này đã kìm hãm sự biểu hiện của một số gen điều hòa các con đường tín hiệu chính như Notch và Wnt của CSCs ruột kết, và loại bỏ các tế bào này. Hơn nữa, evodiamine cũng ức chế sự tăng sinh và gây ra apoptosis trong CSCs dạ dày. Hợp chất này cũng làm giảm biểu hiện của các dấu hiệu tế bào gốc đa năng như Bmi-1, KLF4, Sox2 và Oct4, và các dấu hiệu EMT như Slug, Zeb1, Twist và vimentin. Các quan sát chứng minh rằng evodiamine có tác dụng ức chế lên đường truyền tín hiệu Wnt/β-catenin và EMT, do đó ức chế sự tăng sinh và các đặc tính giống tế bào gốc của CSCs dạ dày.
Các chất phytomedicines nhắm vào đường truyền tín hiệu Notch
Giống như đường truyền tín hiệu Wnt, đường truyền Notch cũng duy trì tính gốc của CSCs. Một loại thuốc y học cổ truyền Trung Quốc (TCM), công thức Qingyihuaji (QYHJ), bao gồm các loại thảo mộc Trung Quốc khác nhau, bao gồm Herba Scutellariae Barbatae, Herba Hedyotdis, Herba seu Radix Gynostemmatis Pentaphylli, Rhizoma Arisaematis Erubescentis và Fructus Amomi Rotundus, đã được phát hiện là nhắm vào đường truyền tín hiệu Notch. Công thức này làm giảm biểu hiện CD133 trên CSCs tuyến tụy. Ngoài ra, nó còn làm giảm biểu hiện của gen Notch-4, nhưng khi kết hợp với gemcitabine, nó cũng ức chế đáng kể biểu hiện của các gen Notch-1, Notch-2 và Notch-3. Hơn nữa, QYHJ, ở liều 36 g/kg, đã ức chế sự tăng trưởng khối u trong mô hình chuột khối u được cấy ghép tế bào SW1990, cho thấy rằng QYHJ có khả năng tăng thời gian sống sót của bệnh nhân bằng cách giảm CSCs tuyến tụy. Tương tự, một công thức TCM khác, Xiaotan Sanjie (XTSJ), bao gồm nhiều loại thảo mộc, đã ức chế khả năng tồn tại của tế bào CSCs dạ dày theo cách phụ thuộc vào liều lượng, được cho là do sự điều hòa giảm biểu hiện của Notch-1, tức là điều hòa sự tăng sinh của CSCs dạ dày. Hơn nữa, XTSJ ở các liều khác nhau (1,46, 2,92 và 5,84 g/mL) đã làm giảm sự tăng trưởng khối u theo cách phụ thuộc vào liều lượng trong mô hình chuột được cấy ghép CSC dạ dày. Một chế phẩm TCM rất phổ biến khác, Pien Tze Huang (PZH), làm giảm tỷ lệ phần trăm các tế bào quần thể phụ trong tế bào SW480. Ngoài ra, nó làm giảm khả năng tồn tại của các tế bào quần thể phụ theo cách phụ thuộc vào liều lượng và gây ra apoptosis trong các tế bào quần thể phụ này, bằng chứng là nhân bị phân mảnh và chất nhiễm sắc bị cô đặc. Sau đó, PZH đã điều chỉnh giảm biểu hiện gen Notch1 trong CSCs ruột kết, chứng minh tác dụng của nó như một tác nhân mạnh nhắm mục tiêu CSC. Tiếp theo, Psoralidin, một dẫn xuất coumestans prenylated được phân lập từ hạt của Psoralea corylifolia, đã ức chế tín hiệu Notch-1 trong CSCs vú thúc đẩy sự ức chế các dấu hiệu EMT. Điều này dẫn đến giảm sự xâm lấn và di chuyển của ALDH+ vú CSCs. Hơn nữa, nó ức chế sự tăng trưởng và gây ra cái chết tế bào theo chương trình trong CSCs vú .
Các chất phytomedicines nhắm vào đường truyền tín hiệu Hedgehog
Đường truyền tín hiệu Hh cũng đóng một vai trò quan trọng trong việc duy trì tính gốc của CSCs. Ngoài ra, nhiều nghiên cứu đã chứng minh rằng sự mất cân bằng của đường truyền Hh đóng một vai trò quan trọng trong quá trình hình thành khối u cũng như khả năng kháng thuốc ở nhiều loại ung thư bằng cách thúc đẩy sự tăng sinh, ác tính, di căn của tế bào ung thư và sự mở rộng của CSCs. Việc nhắm mục tiêu vào con đường truyền tín hiệu này bằng phytomedicines có thể ức chế sự tăng sinh và phát triển của CSCs. Withaferin A, một lactone được phân lập từ chiết xuất lá của Withania somnifera, đã ức chế hoạt động phiên mã của phức hợp GLI1-DNA được hình thành trong quá trình truyền tín hiệu Hh ở các CSC khác nhau. Hợp chất này thể hiện độc tính tế bào mạnh mẽ chống lại các tế bào ung thư PANC1, DU145 và MCF7. Một trong những hợp chất phyto phổ biến curcumin, được phân lập từ thân rễ của củ nghệ (Curcuma longa), đã được chứng minh là ức chế đường Sonic Hh và làm giảm biểu hiện của các dấu hiệu CSC vú (ALDH1, CD44, OCT4 và CD133). Điều này gây ra sự ngừng tăng sinh tế bào và gây ra cái chết tế bào theo chương trình ở CSCs vú. Hơn nữa, một thành phần khác, sulforaphane, được phân lập từ các loại rau họ cải bao gồm bông cải xanh, đã được chứng minh là ngăn chặn đường Sonic Hh (Smo, Gli-1, 2) và giảm các dấu hiệu của EMT (Zeb-1), đa năng (Oct4, Nanog), tạo mạch (VEGF, PDGFRα) và di căn trong CSCs tuyến tụy. Điều này dẫn đến việc gây ra apoptosis ở CSCs tuyến tụy, và do đó làm giảm đáng kể sự tăng trưởng khối u ở chuột NSG được cấy ghép CSC tuyến tụy.
Một chế phẩm chiết xuất từ nhiều loại thảo mộc, BRM270 (BRMLife), bao gồm bảy loại thảo dược, bao gồm Saururus chinensis, Citrus unshiu Markovich, Aloe vera, Arnebia euchroma, Portulaca oleracea, Prunella vulgaris var. lilacina và Scutellaria bacicalensis, đã được phát hiện là có khả năng ức chế di căn và tính gốc (SALL4, CD133, Nanog, Sox2 và Oct4) trong các tế bào ung thư biểu mô tuyến tụy CD44+ (PDACs) thông qua con đường Sonic Hh. BRM270 ở liều 5 mg/kg đã làm giảm sự phát triển khối u trong mô hình chuột PDAC-xenograft CD44+. Trong một nghiên cứu khác, baicalein, một hợp chất hoạt tính sinh học tự nhiên chủ yếu có trong Scutellaria bacicalensis và nhiều công thức thảo dược khác, bao gồm QYHJ, đã được chứng minh là làm giảm các dấu hiệu đa năng (Sox2, Oct4) và các thành viên của con đường truyền tín hiệu Sonic Hh (SHH, SMO và Gli-2) trong PANC1 CSCs. Baicalein đơn độc ở liều 60 mg/kg làm giảm sự phát triển khối u ở chuột nude được cấy ghép PANC1 CSC. Kết quả nghiên cứu nhấn mạnh tác dụng điều trị của baicalein đối với CSCs tuyến tụy. Một công thức khác, MSC500, một chế phẩm thảo dược của Hàn Quốc được tạo thành từ chủ yếu tám loại thảo mộc, bao gồm Phellinus linteus, Gastrodiaelata và lá dâu tằm, cũng cho thấy khả năng điều chỉnh các con đường truyền tín hiệu Hh. Chế phẩm thảo dược này đã điều chỉnh cả ba con đường truyền tín hiệu (Notch, Wnt và Sonic Hedgehog) cần thiết cho tính gốc của các tế bào giống tế bào gốc u nguyên bào thần kinh đệm. MSC500 ức chế các gen gốc cũng như các dấu hiệu CSC (Oct4, Sox2, ABCB5, Gli1, Notch1 và β-catenin) trong quần thể phụ của tế bào ung thư GBM8401. Điều này dẫn đến việc làm giảm tỷ lệ phần trăm của các tế bào quần thể phụ. Đã có báo cáo rằng MSC500 có tác dụng mạnh mẽ chống lại u thần kinh đệm cấp cao, và nó có thể là một giải pháp đầy hứa hẹn cho bệnh u thần kinh đệm.
Ngoài hoạt tính trên CSCs, các phytomedicines còn được phát hiện có khả năng cải thiện độ nhạy cảm của CSCs với các loại thuốc hóa trị thông thường. Ovatodiolide, một diterpenoid macrocyclic được phân lập từ Anisomeles indica (L.) Kuntze, đã tăng cường tác dụng hóa trị của temozolomide đối với các tế bào giống tế bào gốc u nguyên bào thần kinh đệm. Nó cũng tăng cường hiệu quả điều trị của cisplatin cho CSCs ung thư vòm họng và ung thư miệng. Tương tự, sulforaphane, thường được tìm thấy trong các loại rau họ cải, đã tăng cường tác dụng điều trị của cisplatin đối với ung thư vòm họng. Curcumin, một trong những tác nhân ăn kiêng tự nhiên được nghiên cứu nhiều nhất, đã cải thiện độ nhạy cảm của paclitaxel, cisplatin, doxorubicin và mitomycin C đối với CSCs vú. Tương tự, ginsenoside-Rb1, một hợp chất phổ biến được phân lập từ Panax notoginseng, đã cải thiện hiệu quả điều trị của cả cisplatin và paclitaxel, là những loại thuốc hóa trị thường được sử dụng cho CSCs buồng trứng. Carnosol, một diterpene phenolic thường có trong hương thảo và xô thơm, đã làm nhạy cảm CSCs u nguyên bào thần kinh đệm với temozolomide để tăng cường tác dụng chống tăng sinh của nó. Tương tự, sự kết hợp của chiết xuất nước từ các bộ phận trên không của Gynura divaricata với cisplatin/doxorubicin/5-Fluorouracil đã cho thấy mức độ hiệp đồng cao trong điều trị ung thư biểu mô tế bào gan bằng cách tăng cường độc tính tế bào của CSCs gan.
Những nghiên cứu này chứng minh rằng phytomedicines không chỉ giúp giảm sức đề kháng của CSCs đối với điều trị mà còn thể hiện khả năng hiệp đồng tác dụng với các loại thuốc hóa trị hiện đại bằng cách cải thiện độ nhạy cảm của tế bào ung thư đối với thuốc hóa trị khi được sử dụng kết hợp. Dựa trên các nghiên cứu đã được trình bày, cần khuyến khích thực hiện nhiều nghiên cứu hơn nữa để khám phá tác dụng nhạy cảm hóa trị của phytomedicines, có thể được sử dụng như một chất bổ trợ, giúp giảm liều lượng của các loại thuốc hóa trị hiện đại thường gây độc tính hạn chế liều, do đó hạn chế việc sử dụng chúng trong lâm sàng. Việc nhắm mục tiêu các hợp chất phytomedicinal trong các con đường truyền tín hiệu ở CSCs đã được tóm tắt trong Bảng 3.
Bảng 3. Các hợp chất thực vật nhắm vào các đường truyền tín hiệu Wnt/β-catenin, Notch và Sonic Hedgehog trong CSC.
|
Nguồn thực vật |
Trích xuất |
Hợp chất hoạt tính sinh học |
Liều lượng trong Vivo |
Dòng tế bào/Mô hình |
|
|---|---|---|---|---|---|
| Abrus preatorius | Chiết xuất hạt | Abrus agglutinin | 50 mg/kg | Tế bào giống ung thư biểu mô vảy miệng và chuột khối u xenograft | |
| Cây hoàng liên (TCM) |
—— | máu huyết | 0,5 mg/20 g | CSC phổi và chuột khối u xenograft | |
| Gynura phân chia | Dịch chiết nước của phần trên không | —— | 300 mg/kg | CSC tế bào gan và chuột khối u xenograft | |
| Panax quinquefolius | —— | Ginsenoside-Rb1 | 50 mg/kg | CSC buồng trứng và chuột khối u xenograft | |
| cây tỏi | —— | Diallyl-trisulfua | —— | CSC đại trực tràng | |
| Murraya koenigii (L) Mùa xuân | Chiết xuất lá | Koenimbin | —— | CSC vú | |
| Cảm ứng apoptosis thông qua con đường nội tạiBắt pha G0/G1 | —— | CSC tuyến tiền liệt | |||
| Chelidonium majus/Macleaya cordata | —— | Chelerythrine clorua | —— | Tế bào gốc ung thư phổi không phải tế bào nhỏ | |
| Evodiae rutaecarpa | —— | Evodiamine | —— | CSC dạ dày | |
| quả Evodiae | —— | Evodiamine | —— | CSC đại tràng | |
| Baizuan (TCM) |
—— | Gomisin M2 | 10 μM | CSC vú và xenograft cá ngựa vằn | |
| Rau cải |
—— | Sulforaphane | 60 mg/kg | CSC mũi họng và chuột khối u xenograft | |
| Ức chế con đường miR-19 và Wnt/-catenin | —— | CSC phổi | |||
| Điều chế con đường Sonic hedgehog–GliỨc chế các dấu hiệu đa năng, dấu hiệu hình thành mạch và dấu hiệu EMT | —— | CSC tuyến tụy | |||
| Curcuma longa | —— | tinh bột nghệ | —— | CSC bàng quang | |
| Withania somnifera | Chiết xuất lá | Withaferin A | —— | CSC tuyến tụy, tuyến tiền liệt và vú | |
| BRM270 | Chiết xuất rượu | —— | 5 mg/kg | Tế bào gốc ung thư biểu mô tuyến tụy và chuột khối u xenograft | |
| Qingyihuaji (TCM) |
—— | baicalein | 20 hoặc 60 mg/kg | CSC tuyến tụy và chuột khối u xenograft | |
| Qingyihuaji (TCM) |
Dung dịch nước | —— | 36 gam/kg | Tế bào giống ung thư tuyến tụy và chuột khối u xenograft | |
| Tiểu Đàn Tam Giới (TCM) |
—— | —— | 1,46, 2,92 và 5,84 g/mL | CSC dạ dày và chuột khối u xenograft | |
| Psoralea corylifolia | —— | Psoralidin | —— | CSC vú | |
| PienTze Huang (TCM) |
—— | —— | —— | CSC đại trực tràng | |
| MSC500 | —— | —— | —— | Tế bào gốc u nguyên bào thần kinh đệm |
Các nghiên cứu lâm sàng về phytomedicines
Trong những năm gần đây, một số ít các nghiên cứu lâm sàng đã được thực hiện để đánh giá tính an toàn và hiệu quả của phytomedicines nhắm vào CSCs và tế bào ung thư kháng thuốc. Ở những bệnh nhân bị bệnh bạch cầu dòng tủy cấp tính, các hạt Zhebei (chế phẩm của ba loại thảo mộc) kết hợp với hóa trị đã được chứng minh là làm giảm tỷ lệ phần trăm của các tế bào gốc ung thư bạch cầu CD34+, CD123+ và CD33+, CD123+. Tình trạng lâm sàng của một số phytomedicines nhắm mục tiêu CSCs đã được tóm tắt tổng quát trong Bảng 4.
Bảng 4. Tình trạng lâm sàng của các hợp chất dược thực vật nhắm vào CSC.
|
Thử nghiệm lâm sàng số |
Nhà tài trợ và cộng tác viên |
Tiêu đề của nghiên cứu |
Tình trạng lâm sàng |
Năm học |
|---|---|---|---|---|
| Rau họ cải/Sulforaphane | ||||
| NCT00982319 | Trung tâm Ung thư Toàn diện Sidney Kimmel tại Johns Hopkins | Nghiên cứu đánh giá tác dụng của Sulforaphane trong chiết xuất mầm bông cải xanh đối với mô vú | Giai đoạn 2 | 2009–2013 |
| NCT03665922 | Đại học Pittsburgh | Dấu ấn sinh học của Sulforaphane/Chiết xuất mầm bông cải xanh trong ung thư tuyến tiền liệt | Tuyển dụng (Giai đoạn không áp dụng) | 2019–2024 |
| 2.tinh bột nghệ | ||||
| NCT01740323 | Andrew H Miller và Viện Ung thư Quốc gia | Nghiên cứu giai đoạn II về Curcumin so với giả dược đối với bệnh nhân ung thư vú được điều trị bằng hóa trị đang trải qua xạ trị | Giai đoạn 2 | 2015–2018 |
| NCT03980509 | Đại học Y khoa Nam Carolina | Một “Thử nghiệm cửa sổ” về Curcumin đối với các khối u nguyên phát ung thư vú xâm lấn | Giai đoạn 1 | 2020–2021 |
| NCT03072992 | Trung tâm Ung thư Quốc gia, Armenia và BRIU GmbH | “Curcumin” kết hợp với hóa trị trong ung thư vú tiến triển | Giai đoạn 2 | 2017–2019 |
| 3.Rau họ cải/Phenethyl isothiocyanate (PEITC) | ||||
| NCT01790204 | Đại học Georgetown | Nghiên cứu về tác động của PEITC lên tế bào miệng với đột biến p53 | Giai đoạn 2 | 2012–2014 |
| NCT00691132 | Đại học Minnesota và Viện Ung thư Quốc gia | Phenethyl Isothiocyanate trong việc ngăn ngừa ung thư phổi ở người hút thuốc | Giai đoạn 2 | 2009–2013 |
| 4.Tỏi | ||||
| NCT00079170 | Viện ung thư quốc gia | Docetaxel Plus Tỏi trong điều trị bệnh nhân ung thư vú di căn hoặc tiến triển cục bộ | Nghiên cứu thí điểm (Giai đoạn không áp dụng) | 2004–2007 |
| 5.Berberin | ||||
| NCT02226185 | Đại học Y khoa Thượng Hải Jiao Tong | Nghiên cứu Berberine Hydrochloride trong phòng ngừa tái phát u tuyến đại trực tràng | Giai đoạn 3 | 2014–2018 |
| 6.cam thảo | ||||
| NCT00176631 | Rutgers, Đại học Bang New Jersey và Viện Ung thư Quốc gia | Chiết xuất rễ cam thảo và Docetaxel trong điều trị bệnh nhân ung thư tuyến tiền liệt di căn không đáp ứng với liệu pháp hormone | Giai đoạn 2 | 2007–2008 |
| 7.N-butylidenephtalit | ||||
| NCT03234595 | Công ty TNHH Công nghệ sinh học Everfront | Một nghiên cứu pha I/IIa về Temozolomide bổ trợ Cerebraca Wafer Plus (TMZ) ở những bệnh nhân bị u thần kinh đệm cấp độ cao tái phát | Giai đoạn 2 | 2017–2021 |
| số 8.Ginsenoside | ||||
| NCT02714608 | Công ty dược phẩm Tasly | Một nghiên cứu về thuốc nhỏ giọt Ginsenoside H điều trị ung thư phổi không phải tế bào nhỏ giai đoạn nặng (NSCLC) | Giai đoạn 2 | 2016–2018 |
| 9.Ashwagandha | ||||
| NCT00689195 | Bệnh viện Tata Memorial và Pharmanz Herbals Pvt Limited (PHPL) | |||