Tóm tắt: 35 chủng Tụ cầu vàng và 45 chủng Trực khuẩn mủ xanh phân lập được từ máu bệnh nhân bị bỏng nặng nằm điều trị tại khoa Hồi sức cấp cứu – Viện Bỏng quốc gia (Từ tháng 8/2002 đến 8/2003) đã được xác định tính nhạy cảm kháng sinh và áp dụng kỹ thuật phối hợp kháng sinh trên môi trường lỏng để xác định các cặp kháng sinh cho hiệu quả diệt khuẩn nhanh nhất, nhằm giúp các thầy thuốc lâm sàng điều trị bằng kháng sinh an toàn và hiệu quả. Kết quả cho thấy: 100% chủng Tụ cầu vàng kháng đa kháng với 6 loại kháng sinh: Penicillin, Erythromycin, Kanamycin, Tobramycin, Gentamycin, Oxacillin, và đặc biệt có 36 % chủng kháng với Vancomycin và 45 % chủng kháng với Teicoplanin. 100% chủng Trực khuẩn mủ xanh kháng đa kháng với 8 loại kháng sinh: Ticarcillin, Piperacillin, Aztreonam, Ceftazidim, Cefsulodin, Cefoperazol, Gentamycin, Tobramycin và đặc biệt có 50% chủng kháng với Ciprofloxacin. Các cặp phối hợp kháng sinh cho hiệu quả diệt khuẩn nhanh nhất (lặp lại nhiều lần) thu được trong nghiên cứu này là: Rifampicin + Acid fucidic hoặc Rifampicin + Vancomycin có hiệu quả đối với chủng Tụ cầu vàng và Imipenem + Fosfomycin hoặc Imipenem + Netilmicin hoặc Imipenem + Piperacillin/ Tazobactam có hiệu quả đối với chủng Trực khuẩn mủ xanh.
Đặt vấn đề:
Xác định tính nhạy cảm kháng sinh của các vi khuẩn gây bệnh bằng kỹ thuật khoanh giấy khuếch tán trên thạch đã trở nên thông dụng trong tất cả các phòng thí nghiệm vi sinh vật trên thế giới, kết quả của công việc này đã đóng góp không nhỏ trong cuộc chiến chống lại các bệnh nhiễm trùng do vi khuẩn gây nên ở loài người. Song hiệu quả của nó chưa được cao, bởi sự kháng lại kháng sinh ngày càng mạnh mẽ của vi khuẩn, đặc biệt là sự kháng chéo của nó với các kháng sinh trong cùng một họ đã làm các thầy thuốc lâm sàng bị thất bại trong điều trị mặc dù họ đã tuân thủ theo kết quả kháng sinh đồ.
Việc điều trị bằng kháng sinh các bệnh nhiễm trùng, đặc biệt là nhiễm trùng bệnh viện (trong đó có nhiễm trùng ở bệnh nhân bỏng) là công việc hết sức khó khăn. Đứng hàng đầu trong các căn nguyên gây nhiễm trùng bệnh viện hiện nay phải kể đến: Trực khuẩn mủ xanh (Pseudomonas aeruginosa) và Tụ cầu vàng (Staphylococcus aureus), những chủng này luôn kháng rất nhiều loại kháng sinh khác nhau và thường kháng ở mức độ rất cao.
Đã nhiều năm nay, các phòng thí nghiệm vi sinh vật ở các nước phát triển, đã thực hiện kỹ thuật phối hợp kháng sinh để xác định hiệu quả diệt khuẩn nhanh nhất khi cho phối hợp kháng sinh. Kết quả này cho phép các thầy thuốc lâm sàng điều trị các nhiễm trùng bệnh viện một cách hiệu quả, an toàn và kinh tế nhất. Vì vậy, kỹ thuật này đã trở thành thông dụng và là biện pháp hỗ trợ được đắc lực cho các bác sỹ lâm sàng trong điều trị, góp phần hạn chế được sự gia tăng tính kháng kháng sinh của vi khuẩn.
Đánh giá tính nhạy cảm kháng sinh của các vi khuẩn gây bệnh là việc làm thường xuyên của các phòng thí nghiệm vi sinh vật của tất cả các bệnh viện ở Việt Nam, nhưng cho đến nay, công việc này mới chỉ dừng lại ở việc đánh giá tính nhạy cảm kháng sinh của vi khuẩn gây bệnh với từng kháng sinh đơn độc, điều đó đã hạn chế phần nào công tác điều trị của các thầy thuốc lâm sàng.
Hiện nay việc điều trị tình trạng nhiễm trùng bằng kháng sinh những bệnh nhân bị bỏng ở Viện Bỏng Quốc gia đang gặp rất nhiều trở ngại, đứng hàng đầu trong các căn nguyên gây nhiễm trùng bệnh viện cũng là các chủng vi khuẩn: Tụ cầu vàng và Trực khuẩn mủ xanh, những chủng này đã kháng rất nhiều loại kháng sinh khác nhau, đặc biệt là kháng cả những kháng sinh thế hệ mới như: Ceftazidim, Ciprofloxacin, Imipenem, Vancomycin và Teicoplanin... Các bác sỹ lâm sàng thường điều trị theo kinh nghiệm và dùng nhiều loại kháng sinh thế hệ mới như trên với liều cao để điều trị bao vây. Nhưng hiệu quả điều trị bị hạn chế, bệnh nhân vẫn phải chịu sự chi phí cao (các thuốc kháng sinh thế hệ mới rất đắt tiền), và hậu quả dẫn đến: việc điều trị rất tốn kém, hiệu quả thấp, thời gian điều trị lâu, độc tính cao và sẽ dẫn đến tình trạng xuất hiện ngày càng nhiều chủng vi khuẩn kháng kháng sinh (do qui luật chọn lọc tự nhiên).
Thực hiện kỹ thuật phối hợp kháng sinh trong phòng thí nghiệm vi sinh vật sẽ là biện pháp hỗ trợ đắc lực giúp cho các bác sỹ lâm sàng tránh được tình trạng trên. Nhưng hiện nay ở Việt Nam chưa có phòng thí nghiệm nào thực hiện kỹ thuật này.
Vì vậy, việc áp dụng kỹ thuật phối hợp kháng sinh trong công tác điều trị nhiễm trùng nặng ở bệnh nhân bỏng là việc làm cần thiết và cấp bách, nhằm đáp ứng kịp thời cho công tác điều trị và phòng tránh sự gia tăng tính kháng kháng sinh của những vi khuẩn gây nhiễm trùng bệnh viện.
Đối tượng nghiên cứu:
Các chủng Tụ cầu vàng và Trực khuẩn mủ xanh phân lập được từ bệnh nhân bị nhiễm trùng máu nằm điều trị tại khoa Hồi sức cấp cứu của Viện Bỏng Quốc gia (Do phòng thí nghiệm Vi sinh vật – Khoa Cận lâm sàng của Viện Bỏng tiến hành phân lập).
Các chủng trên sẽ được chuyển về phòng thí nghiệm kháng sinh 2 - Khoa Vi khuẩn - Viện Vệ sinh dịch tễ trung ương làm kháng sinh đồ và phối hợp kháng sinh.
Vật liệu nghiên cứu:
Chủng chuẩn quốc tế: Staphylococcus aureus ATCC 25923
Pseudomonas aeruginosa ATCC 27853
Môi trường và sinh phẩm:
Môi trường làm kháng sinh đồ và phối hợp kháng sinh trong môi trường lỏng:
Canh thang và thạch Muller – Hinton của hãng Bio-Rad.
Thạch thường : do Viện Vệ sinh dịch tễ trung ương sản xuất.
Khoanh giấy kháng sinh: 32 loại khoanh giấy kháng sinh của hãng Bio-Rad. (Xem danh sách tên các loại kháng sinh trong bảng 1.)
Phương pháp nghiên cứu:
Thực nghiệm labo và mô tả.
Thời gian thực hiện: Từ tháng 8/ 2002 đến tháng 8/2003.
Kỹ thuật khoanh giấy khuếch tán
Thực thiện theo kỹ thuật Kirby-Bauer [2].
Khoanh giấy kháng sinh của hãng Bio-Rad, được chọn thích hợp cho từng loại vi khuẩn [8].
Bảng 1: Danh sách các loại khoanh giấy kháng sinh dùng để xác định tính nhạy cảm kháng sinh với mỗi loại vi khuẩn.
| TT | Tụ cầu vàng | Trực khuẩn mủ xanh |
| 1 | Penicillin | Ticarcillin |
| 2 | Erythromycin | Ticarcillin/clavulanic acid |
| 3 | Lincomycin | Piperacillin |
| 4 | Pristinamycin | Piperacillin/Tazobactam |
| 5 | Kanamycin | Aztreonam |
| 6 | Tobramycin | Immipenem |
| 7 | Gentamycin | Ceftazidim |
| 8 | Chloramphenicol | Cefsulodin |
| 9 | Tetracyclin | Cefoperazon |
| 10 | Cotrimoxazol | Pefloxacin |
| 11 | Acid fucidic | Ciprofloxacin |
| 12 | Rifampicine | Fosfomycin |
| 13 | Fosfomycin | Gentamycin |
| 14 | Pefloxacin | Tobramycin |
| 15 | Vancomycin | Netilmicin |
| 16 | Teicoplanin | Amikacin |
| 17 | Oxacillin |
|
Các chủng vi khuẩn chuẩn Quốc tế là S. aureus ATCC 25923 và P. aeruginosa ATCC 27853 luôn được làm thí nghiệm định kỳ 1 tháng 1 lần để kiểm tra các yếu tố kỹ thuật, chất lượng môi trường, chất lượng khoanh giấy kháng sinh.
Kết quả xác định tính nhạy cảm kháng sinh của các chủng chuẩn và chủng thử nghiệm được đánh giá dựa theo bảng chuẩn năm 2003 của Hội đồng tư vấn về kháng sinh thuộc Hội Vi sinh học Pháp (CASFM) [11].
Kỹ thuật phối hợp kháng sinh: Thực hiện theo kỹ thuật phối hợp kháng sinh trong môi trường lỏng của Courvalin [10] [5].
Tất cả các chủng sau khi có kết quả kháng sinh đồ đều được áp dụng kỹ thuật phối hợp kháng sinh để tìm ra các cặp kháng sinh phối hợp có hiệu quả diệt khuẩn nhanh nhất. Những kết quả này sẽ được vẽ biểu thị dưới dạng đồ thị (xem đồ thị 1. và 2.) và thông báo ngay cho các thầy thuốc lâm sàng nhằm đáp ứng kịp thời trong công tác điều trị.
Việc lựa chọn kháng sinh để thực hiện kỹ thuật phối hợp kháng sinh được tiến hành dựa trên một số yếu tố:
- Kết quả kháng sinh đồ cụ thể của từng bệnh nhân, chọn các kháng sinh cho kết quả nhạy cảm hoặc tính nhạy cảm bắt đầu giảm, sẽ được lựa chọn để thực hiện kỹ thuật phối hợp kháng sinh (thường chọn 3 đến 4 loại kháng sinh khác nhau).
- Dựa vào nguyên tắc lựa chọn kháng sinh phối hợp (chọn những kháng sinh cho kết quả hiệp đồng và tránh những kháng sinh cho kết quả đối kháng) [10][5].
- Dựa vào lứa tuổi của bệnh nhân, đặc biệt ở trẻ em dưới 15 tuổi, để tránh không sử dụng kháng sinh Floroquinolon, chlorampheniol … hay không dùng Tetracyclin cho trẻ nhỏ dưới 7 tuổi.
Kết quả
Trong thời gian thực hiện nghiên cứu chúng tôi đã thu thập được 35 chủng tụ cầu vàng và 45 chủng Trực khuẩn mủ xanh. Dưới đây là kết quả nghiên cứu:
Tính nhạy cảm kháng sinh
Bảng 2: Tính nhạy cảm kháng sinh của 35 chủng Tụ cầu vàng
| Họ kháng sinh | Kháng sinh | Viết tắt | Tỷ lệ % mức độ nhạy cảm | ||
| Kháng (R) | Trung gian (I) | Nhạy cảm (S) | |||
| b-lactamin (penicillin G) | Penicillin | PEN | 100 |
|
|
| Macrolid | Erythromycin | ERY | 100 |
|
|
| Lincosamid | Lincomycin | LIN | 73 | 18 | 9 |
| Streptogramin | Pristinamycin | PRI | 36 | 19 | 45 |
| Aminosid | Kanamycin | KAN | 100 |
|
|
| Tobramycin | TOB | 100 |
|
| |
| Gentamycin | GEN | 100 |
|
| |
| Phenicol | Chloramphenicol | CHL | 55 | 27 | 18 |
| Tetracyclin | Tetracyclin | TET | 91 | 9 |
|
| Sulfamid+Trimethoprim | Cotrimoxazol | SXT | 64 |
| 36 |
| Acid fucidic | Acid fucidic | FUS | 27 | 8 | 55 |
| Rifamycine | Rifampicine | RIF | 18 | 27 | 55 |
| Fosfomycin | Fosfomycin | FOS | 36 | 9 | 55 |
| Fluoroquinolon | Pefloxacin | PEF | 91 |
| 9 |
| Glycopeptid | Vancomycin | VAN | 36 |
| 64 |
| Teicoplanin | TEI | 45 | 37 | 18 | |
| b-lactamin (Penicillin M) | Oxacillin | OXA | 100 |
|
|
Kết quả này cho thấy những chủng Tụ cầu vàng mà chúng tôi thu được đã kháng kháng sinh rất mạnh: Kháng 100% với 6 loại kháng sinh trên tổng số 17 loại thử nghiệm: Penicillin, Erythromycin, Kanamycin, Tobramycin, Gentamycin và Oxacillin; kháng 64-91% với các kháng sinh: Lincomycin, Tetracyclin, Cotrimoxazol, Pefloxacin. Đặc biệt đã có 36% chủng Tụ cầu vàng kháng Vancomycin và 45 % kháng Teicoplanin, những chủng này đã được kiểm tra lại tính kháng bằng kỹ thuật xác định nồng độ kháng sinh tối thiểu ức chế vi khuẩn (trên môi trường lỏng) với kháng sinh Vancomycin, kết quả đều cho thấy MIC là 125 mg/ml (Theo NCCLS : MIC >= 16 mg/ml đã là kháng [9]), điều này khẳng định sự kháng lại hai kháng sinh này của chủng vi khuẩn.
Bảng 3: Tính nhạy cảm kháng sinh của 45 chủng Trực khuẩn mủ xanh
| Họ kháng sinh | Kháng sinh | Viết tắt | Tỷ lệ % mức độ nhạy cảm | ||
| Kháng (R) | Trung gian (I) | Nhạy cảm (S) | |||
| b-lactamin (Carboxypenicillin) | Ticarcillin | TIC | 100 |
|
|
| Ticarcillin/ clavulanic acid | TIM | 85 | 15 |
| |
| b-lactamin (Ureidopenicillin) | Piperacillin | PIP | 100 |
|
|
| Piperacillin/Tazobactam | PTA | 60 | 40 |
| |
| b-lactamin (Monobactam) | Aztreonam | ATM | 100 |
|
|
| b-lactamin (Carbapenem) | Immipenem | IMP |
|
| 100 |
| b-lactamin (Cephalosporin thế hệ 3) | Ceftazidim | CAZ | 100 |
|
|
| Cefsulodin | CFS | 100 |
|
| |
| Cefoperazon | CFP | 100 |
|
| |
| Fluoroquinolon | Pefloxacin | PEF | 60 | 30 | 10 |
| Ciprofloxacin | CIP | 50 |
| 50 | |
| Fosfomycin | Fosfomycin | FOS | 70 | 10 | 20 |
| Aminosid | Gentamycin | GEN | 100 |
|
|
| Tobramycin | TOB | 100 |
|
| |
| Netilmicin | NET | 70 | 10 | 20 | |
| Amikacin | AMK | 90 |
| 10 | |
Có 45 chủng Trực khuẩn mủ xanh đã được xác định tính nhạy cảm kháng sinh với 16 loại kháng sinh thuộc 4 họ kháng sinh khác nhau. Kết quả này cho thấy rằng chủng Trực khuẩn mủ xanh đã khángkháng sinh rất mạnh mẽ: kháng 100% với 8 loại kháng sinh trên tổng số 16 loại được thử: Ticarcillin, Piperacillin, Aztreonam, Ceftazidim, Cefsulodin, Cefoperazol, Gentamycin, Tobramycin; Kháng 85% với kháng sinh Ticarcillin/ Acid cluvulanic và kháng 90% với Amikacin; Kháng 70% với kháng sinh Netilmicin và Fosfomycin, kháng 60% với kháng sinh: Piperacillin/Tazobactam và Pefloxacin; Riêng kháng sinh Ciprofloxacin là kháng sinh có phổ tác dụng rất rộng cũng đã kháng 50%.
Kết quả phối hợp kháng sinh
Trong 35 chủng tụ cầu vàng và 45 chủng Trực khuẩn mủ xanh đã thực hiện kỹ thuật phối hợp kháng sinh, mỗi chủng sẽ được lựa chọn các kháng sinh tuỳ thuộc đặc tính kháng kháng sinh của chủng đó và đặc điểm về tuổi tác của mỗi bệnh nhân đã phân lập ra chủng này.
Tụ cầu vàng
Các cặp kháng sinh phối hợp cho hiệu quả diệt khuẩn nhanh nhất đã được lựa chọn để áp dụng trong điều trị, tần suất lựa chọn của các cặp được trình bày trong bảng 4. Có 11 cặp kháng sinh phối hợp cho hiệu quả diệt khuẩn nhanh nhất, trong đó có 5 cặp được lựa chọn nhiều nhất từ 6 đến 9 lần, trong tổng số 35 lần thử nghiệm, điều này khẳng định rằng những kết quả thu được là rất phong phú và mang tính đặc đặc hiệu cao giữa chủng phân lập được với từng bệnh nhân khác nhau.
Bảng 4: Kết quả phối hợp kháng sinh có hiệu quả diệt tụ cầu vàng
| TT | Cặp kháng sinh phối hợp | Số lần được lựa chọn |
| 1 | Rifampicin + Acid fucidic | 9 |
| 2 | Rifampicin + Vancomycin | 6 |
| 3 | Rifampicin + Cotrimoxazol | 6 |
| 4 | Vancomycin + Acid fucidic | 6 |
| 5 | Vancomycin + Cotrimoxazol | 6 |
| 6 | Vancomycin + Fosfomycin | 3 |
| 7 | Vancomycin + Chloramphenicol | 3 |
| 8 | Rifampicin + Erythromycin | 3 |
| 9 | Rifampicin + Chloramphenicol | 3 |
| 10 | Rifampicin + Pefloxacin | 3 |
| 11 | Erythromycin + Pefloxacin | 3 |
Trực khuẩn mủ xanh
Các cặp kháng sinh phối hợp cho hiệu quả diệt khuẩn nhanh nhất đã được lựa chọn để áp dụng trong điều trị, tần suất lựa chọn của các cặp được trình bày trong bảng 5. Có 8 cặp kháng sinh phối hợp đã cho hiệu quả diệt khuẩn nhanh nhất, trong đó có 4 cặp đã được lựa chọn 10 đến 15 lần. Cũng như chủng Tụ cầu vàng, điều này đã một lần nữa khẳng định rằng những kết quả thu được là rất phong phú và mang tính đặc đặc hiệu cao giữa chủng phân lập được với từng bệnh nhân khác nhau.
Bảng 5: Kết quả phối hợp kháng sinh có hiệu quả diệt Trực khuẩn mủ xanh
| TT | Cặp kháng sinh phối hợp | Số lần được lựa chọn |
| 1 | Imipenem + Fosfomycin | 15 |
2 | Imipenem + Netilmicin | 15 |
3 | Imipenem + Piperacillin/ Tazobactam | 15 |
| 4 | Imipenem + Ciprofloxacin | 10 |
| 5 | Imipenem + Pefloxacin | 5 |
| 6 | Ciprofloxacin + Fosfomycin | 5 |
| 7 | Ciprofloxacin + Netilmicin | 5 |
| 8 | Ciprofloxacin + Piperacillin/ Tazobactam | 5 |
Bàn luận
Tính nhạy cảm kháng sinh của các chủng Tụ cầu vàng và Trực khuẩn mủ xanh
Nhiễm khuẩn xuất hiện ở các bệnh nhân bị bỏng là một loại nhiễm khuẩn bệnh viện điển hình (Nhiễm trùng thứ phát). Do đặc điểm của bệnh: khi mới bị bỏng, vết thương hoàn toàn vô trùng, nhưng là vết thương hở khá rộng và luôn xuất tiết dịch và huyết tương, nên trở thành môi trường lý tưởng cho các vi khuẩn ở bệnh phòng xâm nhập vào. Thêm vào đó bệnh nhân bị bỏng thường phải điều trị kéo dài nhiều ngày, để đạt hiệu quả điều trị nhanh, các thầy thuốc lâm sàng thường dùng các loại kháng sinh thế hệ mới có hoạt phổ rộng. Do những đặc điểm này, tính nhạy cảm kháng sinh của các chủng Tụ cầu vàng và Trực khuẩn mủ xanh phân lập được ở những bệnh nhân bị bỏng có đặc tính kháng kháng sinh rất mạnh mẽ và kháng nhiều loại kháng sinh thế hệ mới. Khác hẳn với các nhiễm trùng nguyên phát bởi hai loại vi khuẩn này (phân lập ở các bệnh nhân thuộc các bệnh viện khác), các kháng sinh thế hệ mới có phổ hoạt động rộng vẫn còn có tác dụng tốt. Theo số liệu của chương trình giám sát quốc gia về tính kháng thuốc của vi khuẩn gây bệnh thường gặp ở Việt Nam trong thời gian gần đây nhất cho thấy: chủng Tụ cầu vàng kháng OXA là 46,5%, kháng GEN là 39,6%, kháng CHL là 46,9%, kháng ERY là 46,9%, kháng SXT là 17,2%, kháng NOF là 30,6% và kháng VAN là 0,7% [4]. Hoặc theo số liệu của Tổ chức y tế thế giới thông báo về tính kháng kháng sinh của các chủng gây bệnh của các nước thuộc khu vực Tây Thái Bình Dương cũng cho thấy: một số nước có chủng Tụ cầu vàng kháng kháng sinh ở mức độ cao là Hồng Kông (kháng GEN là 54%, kháng ERY là 2 % và kháng Fluoroquinolon là 72%), nhưng cũng chỉ kháng OXA là 56%; Nam Triều Tiên và khu vực phía Nam Trung quốc là nơi có tỷ lệ Tụ cầu vàng kháng OXA cao nhất trong Khu vực Tây Thái Bình Dương là 70% và 68,4% [7]. Như vậy, những chủng Tụ cầu vàng phân lập được ở bệnh nhân bị bỏng có mức độ kháng kháng sinh mạnh mẽ hơn hẳn, mang đặc tính của những chủng nhiễm trùng bệnh viện rất rõ, 100% chủng kháng OXA. Và do có sự kháng chéo ở những chủng kháng OXA này nên chúng đã kháng với rất nhiều loại kháng sinh như đã phân tích trong phần kết quả. Đặc biệt có 36% chủng Tụ cầu phân lập được kháng lại Vancomycin và 45% kháng Teicoplanin trong khi các chủng Tụ cầu vàng phân lập được ở bệnh viện Bạch Mai năm 1998-1999 chỉ có 0,5% chủng kháng VAN [1]. Cũng giống như chủng Tụ cầu vàng, chủng Trực khuẩn mủ xanh phân lập được ở các bệnh nhân bị bỏng có những đặc tính kháng kháng sinh rất mạnh mẽ, khác hẳn với thông báo của chương trình giám sát quốc gia về tính kháng thuốc của vi khuẩn gây bệnh thường gặp ở Việt nam trong thời gian gần đây nhất: các chủng Trực khuẩn mủ xanh phân lập tại Hà Nội kháng GEN là 59,5% và kháng AMK là 28,8% [3]. So sánh với các nước trong khu vực Tây Thái Bình Dương cho thấy: ở Brunei kháng Ticarcillin cao hơn cả là 30,0% (trong khi đó ở Viện Bỏng là 100%), ở Philipin kháng GEN cao hơn cả là 34,8% (Viện Bỏng là 100%)[6]. Đặc biệt chủng Trực khuẩn mủ xanh phân lập được ở Viện Bỏng 100% kháng kháng sinh Ticarcillin, dẫn đến kháng chéo với tất cả các kháng sinh trong họ b - lactamin, kể cả các kháng sinh được phối hợp với chất ức chế enzym b - lactamase, các kháng sinh thế mới trong họ này như: các Cephalosporin thế hệ 1, 2, 3. Mặc dù có thể có vòng vô khuẩn trong thử nghiệm in vitro với một số loại kháng sinh trên nhưng sẽ thất bại trong in vivo. Như vậy, việc điều trị bằng kháng sinh với các chủng Tụ cầu vàng và Trực khuẩn mủ xanh tại Viện Bỏng đã trở nên hết sức khó khăn, mặc dù Trực khuẩn mủ xanh còn nhạy cảm với kháng sinh Imipenem 100% , nhưng với Trực khuẩn mủ xanh nếu điều trị kháng sinh đơn độc và kéo dài với bất cứ loại kháng sinh nào, chỉ sau 3-4 ngày điều trị, chủng vi khuẩn đã trở nên kháng lại kháng sinh này, mặc dù lúc đầu nó nhạy cảm, điều này đã được chứng minh [9]. Sự cần thiết và cấp bách của việc phối hợp kháng sinh trong điều trị càng trở nên cấp thiết.
Hiệu quả phối hợp kháng sinh
Kỹ thuật phối hợp kháng sinh trên môi trường lỏng có những ưu điểm:
- Sử dụng nguyên vật liệu sẵn có trong các phòng thí nghiệm vi sinh vật (khoanh giấy kháng sin, môi trường Muller – Hinton thạch và canh thang…).
- Thời gian thực hiện không kéo dài: chỉ sau 6h có kết quả kháng sinh đồ đã có thể cho kết quả sơ bộ là cặp phối hợp kháng sinh nào cho hiệu quả diệt khuẩn nhanh nhất, và sau 24h sẽ có kết quả chính xác.
- Là phương tiện đắc lực nhất giúp các thầy thuốc lâm sàng điều trị các nhiễm trùng nặng do vi khuẩn kháng kháng sinh gây nên.
- Kỹ thuật này có thể áp dụng được rộng rãi tại các phòng thí nghiệm vi sinh vật của các bệnh viện.
- Nếu kỹ thuật này được áp dụng hàng ngày và rộng rãi trong các phòng thí nghiệm, nó sẽ giúp làm giảm tỷ lệ gia tăng tính kháng kháng sinh của vi khuẩn gây bệnh ở Việt Nam.
Các cặp phối hợp kháng sinh đã được lựa chọn một cách khoa học và đặc hiệu cho từng chủng ở từng bệnh nhân, vì vậy kết quả thu được rất phong phú, với mỗi chủng có thể có được từ 1 đến 2 cặp kháng sinh phối hợp cho hiệu quả diệt khuẩn nhanh nhất và đặc biệt phù hợp với từng trường hợp, mang tính đặc hiệu cao, phản ánh được tính ưu việt của kỹ thuật phối hợp kháng sinh. Nó khẳng định sự đáp ứng tốt cho công tác điều trị và dự phòng sự gia tăng tính kháng kháng sinh của kỹ thuật này. Kỹ thuật này cần được tiến hành thường xuyên tại các phòng thí nghiệm vi sinh của các bệnh viện, nhằm đáp ứng kịp thời cho công tác điều trị. Chính vì thế việc tổng kết các cặp kháng sinh phối hợp cho hiệu quả diệt khuẩn nhanh nhất đối với các chủng này chỉ mang ý nghĩa thông báo chứ không có ý nghĩa rút ra thành qui luật để có thể máy móc áp dụng cho các trường hợp nhiễm trùng ở những bệnh nhân khác do hai chủng vi khuẩn này gây nên.
Kết luận
Thực hiện kỹ thuật phối hợp kháng sinh trên môi trường lỏng là biện pháp tốt nhất để các nhà vi sinh vật hỗ trợ đắc lực cho công tác điều trị của các thầy thuốc lâm sàng trong các trường hợp nhiễm trùng do vi khuẩn kháng đa kháng sinh. Kỹ thuật này có thể thực hiện được rộng rãi tại các phòng thí nghiệm vi sinh lâm sàng, nhờ đó nó sẽ góp phần tích cực cho công tác dự phòng sự gia tăng tính kháng kháng sinh của vi khuẩn gây bệnh, đặc biệt đối với Tụ cầu vàng và Trực khuẩn mủ xanh gây nhiễm trùng bệnh viện.
Sơ đồ 1. Hiệu quả diệt khuẩn của các phối hợp kháng sinh
(Được biểu thị bằng đồ thị)
Họ và tên bệnh nhân : Nguyễn Thị Cúc Tuổi: 68 tuổi
Điều trị tại khoa : Hồi sức cấp cứu - Viện Bỏng
Chuẩn đoán lâm sàng: Nhiễm trùng máu
Bệnh phẩm : Máu Số: 5
ERY : Erythromycin
PEF : Pefloxacin
ERY + PEF: Erythromycin + Pefloxacin
RIF + PEF: Rifampicin + Pefloxacin
RIF: Rifampicin
ERY + RIF: Erythromycin + Rifampicin
Kết luận: Cặp kháng sinh phối hợp có hiệu quả diệt khuẩn nhanh nhất là: RIF + PEF và ERY + PEF
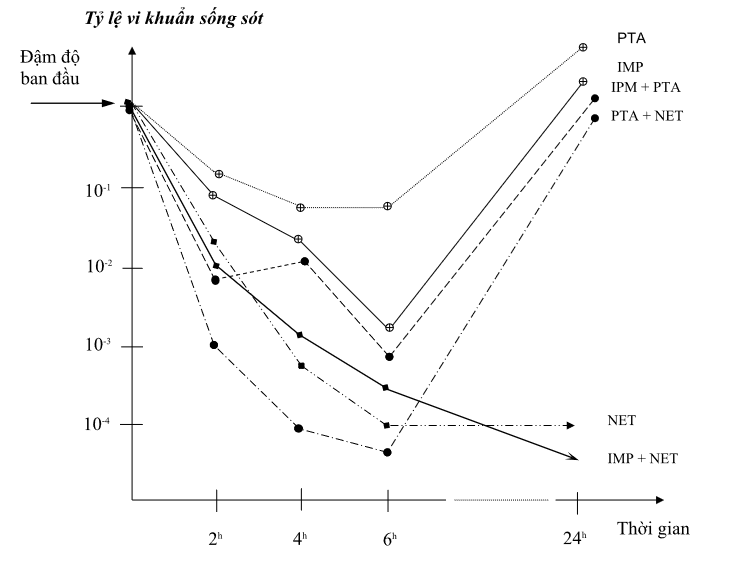
Sơ đồ 2. Hiệu quả diệt khuẩn của các phối hợp kháng sinh
(Được biểu thị bằng đồ thị)
Họ và tên bệnh nhân : Nguyễn Thị Phương Anh Tuổi: 2 tuổi
Điều trị tại khoa : Hồi sức cấp cứu - Viện Bỏng
Chuẩn đoán lâm sàng: Nhiễm trùng máu
Bệnh phẩm : Máu Số: 7
Vi khuẩn phân lập : Pseudomonas aeruginosa
PTA : Piperacillin / Tazobactam NET : Netilmicin
PTA + NET : Piperacillin / Tazobactam + Netilmicin
IMP +PTA : Imipenem + Piperacillin / Tazobactam
IMP +NET : Imipenem + Netilmicin IMP : Imipenem
Kết luận: cặp kháng sinh phối hợp có hiệu quả diệt khuẩn nhanh nhất là: IMP +NET
Tài liệu tham khảo
- Phạm Văn Ca, Đoàn Mai Phương, Đặng Lan Anh, Nguyễn Thị Phương, Nguyễn Xuân Quang, Lê Đăng Hà và cộng sự. (2000). Tình hình kháng kháng sinh của các vi khuẩn gây bệnh tại bệnh viện Bạch Mai năm 1998-1999,
- Nguyễn Thị Thanh Hà. (1991). Phương pháp kỹ thuật khoanh giấy kháng sinh khuếch tán, Nhà xuất bản Văn Hoá, Hà Nội , 328-338.
- Lê Đăng Hà, Phạm Văn Ca và cộng sự. (2000). Mức độ kháng kháng sinh của các chủng Pseudomonas aeruginosagây bệnh ở bệnh viện của một số địa điểm nghiên cứu (năm 1998), , Nhà xuất bản y học, số 1, 6-7.
- Lê Đăng Hà, Lê Huy Chính, Lê Văn Phủng và Phạm Văn Ca. (2001). Một số kết quả của chương trình giám sát quốc gia về tinh kháng thuốc của vi khuẩn gây bệnh thường gặp năm 1999, , Nhà xuất bản y học, số 5, 62.
- Lê Thị Ánh Hồng. (2004). Kỹ thuật phối hợp kháng sinh trong môi trường lỏng. Tạp chí Y học Việt nam, chuyên đề Y học dự phòng, tập 295, ISSN: 0686-3174, 39-48.
- Tổ chức y tế thế giới (WHO).(2000). Mức độ kháng kháng sinh của E. coli và P. aeruginosa ở các nước trong khu vực Tây Thái Bình Dương năm 1998. Thông tin sự kháng thuốc của vi khuẩn gây bệnh, Nhà xuất bản y học, số 1, 11-12.
- Tổ chức y tế thế giới (WHO).(2000). Mức độ kháng kháng sinh của Tụ cầu vàng và Haemophylus influenzae ở các nước trong khu vực Tây Thái Bình Dương năm 1998, Nhà xuất bản y học, số 2, 11-12.
- Jacques ACAR. (1999). Antibiotique susceptibility testing: Intepretation of main resistance phenotypes, Sanofi Diagnostics Pasteur.
- Performance standards for antimicrobial susceptibility testing. (2002). Twelfth informational supplement. M100-S12, Vol.22, No.1, NCCLS.
- Courvalin P. (1985). Association d’antibiotiques, ,MPC/Vigot, Paris, 199-219.
- SOUSSY C.J. (2001). Comite de l’antibiogramme de la societe francaise de microbiologie communique 2000-2001, 29-33.
- Philippe THEVENOT, Francois JEHL, Monique CHOMARAT, Alin GERARD. (2000). Principaux phenotypes de resistance des bacteries a gram negatif aux antibiotiques majeurs, De l’antibiogramme a la prescription, Bio-Merieux, N0. ISBN: 2-9514963-0-3, 40-49.Philippe THEVENOT, Francois JEHL, Monique CHOMARAT, Alin GERARD. (2000). Principaux phenotypes de resistance des bacteries a gram positif aux antibiotiques majeurs, De l’antibiogramme a la prescription, Bio-Merieux, ISBN: 2-9514963-0-3, 50-55.

.PNG)