Huperzine A, một alkaloid loại pyridine có nguồn gốc từ cây Huperzia serrata (Thạch tùng Răng cưa), là một chất ức chế hiệu quả acetylcholinesterase (AChE) và có tác dụng hữu ích trong điều trị bệnh Alzheimer. Các nghiên cứu dược lý đã chỉ ra rằng HupA ức chế acetylcholinesterase một cách có chọn lọc và thuận nghịch. Hơn nữa, HupA thể hiện dược động học tốt, với khả năng hấp thu nhanh, phân bố rộng trong cơ thể và tốc độ thải trừ thấp đến trung bình. Tuy nhiên, hàm lượng HupA trong H. serrata hoang dã, hiện là nguồn chính, tương đối thấp và việc khai thác quá mức đã làm giảm quần thể của H. serrata trong tự nhiên. Thêm vào đó, cây chậm phát triển, năng suất thấp nên khó đáp ứng nhu cầu thị trường. Việc sử dụng nấm nội sinh để sản xuất các chất chuyển hóa thứ cấp đã nổi lên như một hướng nghiên cứu mới, cung cấp một giải pháp thay thế thân thiện với môi trường, tương đối đơn giản và rẻ tiền.
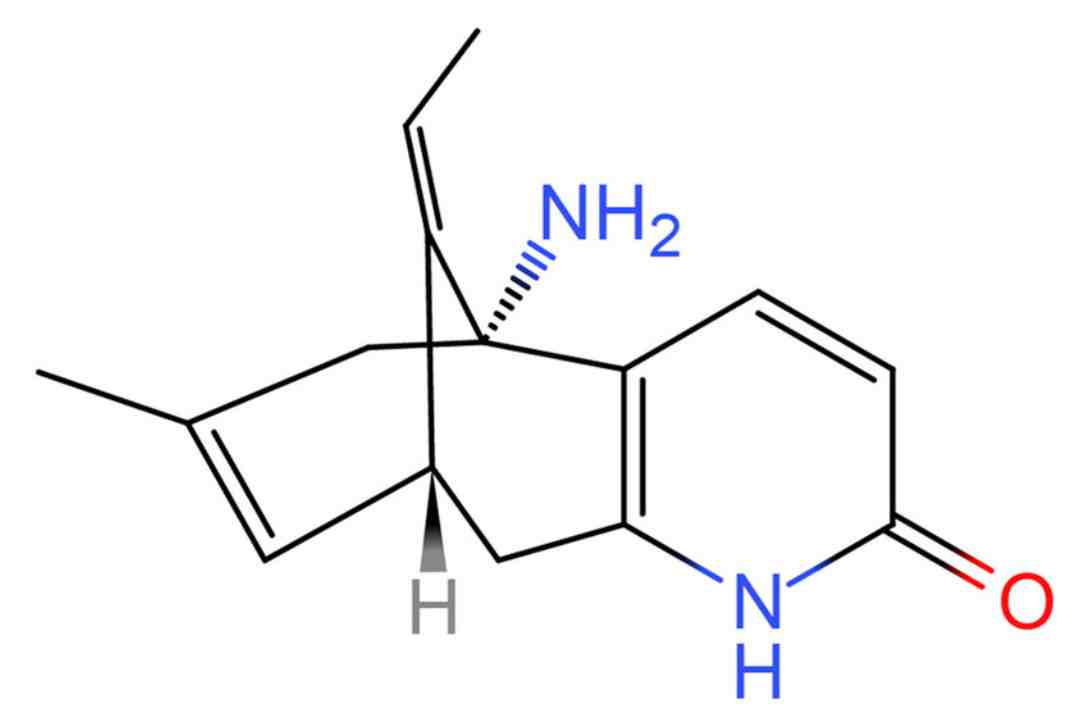
Huperzine A, một alkaloid loại pyridine có nguồn gốc từ cây Huperzia serrata (Thạch tùng Răng cưa)
Hơn 20 năm qua, đã có nhiều nghiên cứu sản xuất HupA ở nấm nội sinh như: tối ưu hóa điều kiện nuôi cấy, gen tái tổ hợp được nhân bản trong ống nghiệm, biểu hiện protein tái tổ hợp, loại bỏ và thay thế gen chức năng đã nâng cao đáng kể hiểu biết của chúng ta về các chiến lược nhằm tăng sản lượng HupA ở nấm nội sinh. Tuy nhiên, không có sự hiểu biết đầy đủ về sự sản sinh HupA ở nấm nội sinh. Ví dụ, cơ sở phân tử cơ bản của quá trình lên men bởi nấm nội sinh để tổng hợp HupA theo cách tương tự như trong trường hợp cây ký chủ (H. serrata hoang dã) vẫn chưa rõ ràng; điều này dẫn đến quá trình nuôi cấy nấm endophytic không ổn định và năng suất thấp. Thông tin về con đường sinh tổng hợp để sản xuất HupA ở nấm nội sinh dựa trên các thí nghiệm in vitro, còn các thí nghiệm in vivo thì không có. Thông tin về việc lựa chọn và bảo quản các dòng sản xuất HupA chất lượng cao và sàng lọc các chất cảm ứng năng suất cao để sản xuất HupA ở nấm nội sinh vẫn còn thiếu.
Do đó, trước mắt có thể lựa chọn quy trình tối ưu hóa điều kiện nuôi cấy, đồng thời sàng lọc các chủng nấm nội sinh thông qua các loài họ thạch tùng kết hợp với đa bội hóa có thể giúp chúng ta thu được các chủng sinh tổng hợp HupA cao để cung cấp nguyên liệu cho sản xuất.
Trong quá trình phân lập nấm nội sinh từ thực vật và lên men nấm nội sinh, các kháng sinh khác nhau được thêm vào môi trường nuôi cấy Potato dextrose agar (PDA), Potato dextrose broth (PDB), Murashige và Skoog (MS) để ngăn ngừa nhiễm vi khuẩn gram dương và âm.
Các kết hợp kháng sinh được sử dụng như sau:
streptomycin (60 µg/mL) và penicillin (100 µg/mL)
ampicillin (100 µg/mL) và cephalosporin (100 µg/mL)
streptomycin (50 µg/mL) và penicillin (100 µg/mL)
amoxicillin (50 µg/mL) và thuốc diệt nấm (50 µg/mL)
streptomycin (50 µg/mL) và ampicillin (100 µg/mL)
Tổng hợp chất chuyển hóa thứ cấp chủ yếu xảy ra trong giai đoạn cuối của sự phát triển của nấm. Quá trình tổng hợp HupA bắt đầu khi tốc độ tăng trưởng cụ thể của tế bào nấm bị giảm, thay vì trong thời kỳ tăng trưởng nhanh (giai đoạn sinh dưỡng). Điều này chỉ ra rằng tốc độ sản xuất HupA không đồng bộ với tốc độ phát triển của nấm. Do vậy, điều kiện nuôi cấy có thể coi là yếu tố quyết định đến năng suất HupA.
Các điều kiện nuôi cấy
| Chủng | Môi trường | Nguồn C (g/L) | Nguồn N (g/L) | Khoáng (g/L) | Tỷ lệ giống (%) | Tuổi giống | Số ngày nuôi | Hup A |
| Alternaria brassicae AGF041 (Zaki et al. 2019) | PDA | Glucose 20 | - | MgSO4 0,37; CaSO4 0,56 | 5,4 | 7 ngày | - | 42,89 µg/g nấm khô |
| Shiraia sp. Slf14 (Zhu et al. 2010) | PDA | Sucrose 20 | Chiết xuất nấm men 5 | KH2PO4 1,0; MgSO4 0,3; KNO3 0,5; KCl 0,5 | 10 | - | 14 | 0,75 µg/L |
| Hypoxylon investiens NX9 (Zhang et al. 2015) | PDA | Mannitol 50; glucose 50 | (NH4)2SO4 10; NaNO3 5 | Mg SO4 0,5 | 8 | 60h | 10 | 27,48 µg/L |
| Colletotrichum gloeosporioides ES026 (Zhao et al. 2013) | PDA | - | - | - | 2 | - | 6 | 156,83 µg/g nấm khô |
| 2F09P03B (Li et al. 2007) | PDA | Maize flour, Cornmeal 30; maltose 25 | Chiết xuất nấm men 10; cám 30 | KH2PO4 1,5; MgSO4 0,5; NaCl 0,3; CaSO4 0,3 | 8 | - | 10 | 8,32 µg/L |
Một số nghiên cứu gần đây đã chứng minh tầm quan trọng của việc tối ưu hóa quá trình lên men cùng với việc sử dụng các chất kích thích hiệu quả để tối đa hóa việc sản xuất các hợp chất có lợi ích kinh tế từ nấm nội sinh.
Việc bổ sung chất kích thích có thể làm tăng sản lượng HupA trong nấm nội sinh. Ethanol và metanol đều có thể được sử dụng làm nguồn cacbon thúc đẩy sự sản sinh HupA. Dịch chiết Thạch tùng răng cưa có các thành phần phức tạp, bao gồm nhiều chất cần thiết cho quá trình tổng hợp HupA và do đó đã chứng minh tác động tích cực đáng kể đến việc sản xuất HupA và được cho rằng có khả năng mạnh nhất để tạo ra HupA bởi nấm nội sinh.
Ví dụ về việc sử dụng kích tố để tăng cường sản lượng HupA
| Chủng | Kích tố | Năng suất nâng cao | Hàm lượng HupA cao nhất | Tham khảo |
| Colletotrichum gloeosporioides ES026 | 1% methanol | 47,05% | 44,35 µg/g | Zhao et al. 2013 |
| Colletotrichum gloeosporioides ES026 | 1% ethanol | 51,89% | 45,81 µg/g | Zhao et al. 2013 |
| Hypoxylon investiens NX9 | 0,05% CH3COONa | Gấp 4 lần | 4,34 µg/L | Zhang et al. 2015 |
| Hypoxylon investiens NX9 | 0,05% C3H3NaO3 | Gấp 4,8 lần | 5,83 µg/L | Zhang et al. 2015 |
| Penicillium polonicum hy4 | Dịch chiết Thạch tùng răng cưa | 0 - 535,54 µg/L | 535,54 µg/L | Kang et al. 2016 |
| Colletotrichum gloeosporioides Cg01 | Dịch chiết Thạch tùng răng cưa | Gấp 26 lần | 556,21 µg/L | Kang et al. 2016 |
| Paecilomyces tenuis YS-13 | Máy lên men sinh học tự động 7L | - | 20,0 µg/L | Su et al. 2017 |
| Shiraia sp. Slf14 | 0,2 g/L L-lysine | 40% | 296,7 µg/L | Sudhakar et al. 2013 |
Như vậy, các yếu tố về môi trường nuôi cấy thích hợp đối với các chủng nấm phân lập từ các loài thuộc họ thạch tùng bao gồm: nguồn carbon, nitrogen, các nguyên tố khoáng, thành phần kích thích bổ sung thêm; môi trường nhân giống, tỷ lệ giống bổ sung, độ thông khí, pH môi trường…
Sản lượng HupA thu được từ các chủng nấm nội sinh ở Việt Nam và thế giới
| Chủng nấm nội sinh | Loài cây | HupA (µg/g nấm khô) | HupA (µg/L) | Nguồn |
| Aspergillus flavus LF40 | H. serrata | 80,1 | - | Wang et al. 2011 |
| Penicillium polonicum hy4 | H. serrata | - | 535,54 | Kang et al. 2016 |
| Penicillium sp. LDL4.4 | H. serrata | 168,9 | 1,38 | Le et al. 2019 |
| Paecilomyces tennis YS-13 | H. serrata | - | 20,0 | Su and Yang 2015 |
| Alternaria brassicae AGF041 | H. serrata | 42,89 | - | Zaki et al. 2019 |
| Shiraia sp. Slf14 | H. serrata | - | 0,66 | Zhu et al. 2010 |
| Cladosporium cladosporioides LF70 | H. serrata | 56,84 | - | Zhang et al. 2011 |
| Colletotrichum gloeosporioides ES026 | H. serrata | 156,83 | - | Shu et al. 2014 |
| Colletotrichum gloeosporioides Cg01 | H. serrata | - | 556,21 | Kang et al. 2016 |
| Hypoxylon investiens NX9 | H.phlegmaria | - | 27,48 | Zhang et al. 2015 |
| Hypoxylon investiens MY311 | H.phlegmaria | - | 40,53 | Zhang et al. 2015 |
| Xylariales sp. SY-02 | H. serrata | - | 24,6 | Su et al. 2011 |
| Fusarium oxysporum SNZ-12 | H. serrata | - | 1,01 | Zhang et al. 2018 |
| Fusarium oxysporum NSG-1 | H. serrata | - | 11,1 | Han et al. 2016 |
| Fusarium verticillioides NSH-5 | H. serrata | - | 117,6 | Han et al. 2017 |
| Fusarium sp. Rsp5.2 | H. serrata | 19,45 | - | Le et al. 2020 |
| Trichoderma L44 | H. serrata | 37,63 | - | Dong et al. 2014 |
| Podospora sp. S29 | H. serrata | 50,6 | - | Dong et al. 2014 |
TS. Hoàng Lâm - Phó Viện trưởng
Lược dịch và bổ sung
Nguồn: doi.org/10.1080/1040841X.2020.1819771