Cúc thơm – Tiềm năng điều trị u đa tủy xương
Bệnh đa u tủy xương là một dạng ung thư máu nguy hiểm, khi các tế bào tương bào ác...
Tảo nâu – Tiềm năng điều trị u limpho
Tảo nâu Nhật Bản (Cladosiphon okamuranus Tokida), còn gọi là Mozuku, là một loại tảo biển thuộc họ Chordariaceae, phân...
Hạt bông
U đa tủy xương là một loại ung thư máu ác tính, phát sinh từ tế bào plasma trong tủy...

Địa chỉ: Số 166, đường Tích Lương, tổ 1, phường Tích Lương, thành phố Thái Nguyên
Điện thoại: 1800 8187
Email: hoangsam.yhocbandia@gmail.com
CHUỖI PHÒNG KHÁM
PHÒNG KHÁM CHUYÊN KHOA Y HỌC CỔ TRUYỀN
- Đ/C: Lô 12B, Ngõ 131, Ngọc Hồi, Hoàng Liệt, Hoàng Mai, Hà Nội
- ĐT: 0904.134.909
PHÒNG CHẨN TRỊ Y HỌC CỔ TRUYỀN TẢ PHÌN HỒ
- Đ/C: Thôn Phìn Hồ 3, xã Tân Thành, huyện Bắc Quang, tỉnh Hà Giang
- ĐT: 0981.406.360
PHÒNG KHÁM NỘI TÂM THẦN - THẦN KINH
- Đ/C: Số 166, tổ 1, phường Tích Lương, TP Thái Nguyên
- ĐT: 0978.875.700
PHÒNG KHÁM NỘI TỔNG HỢP 538
- Đ/C: Số 538, Lương Ngọc Quyến, TP Thái Nguyên
- ĐT: 0913.618.359
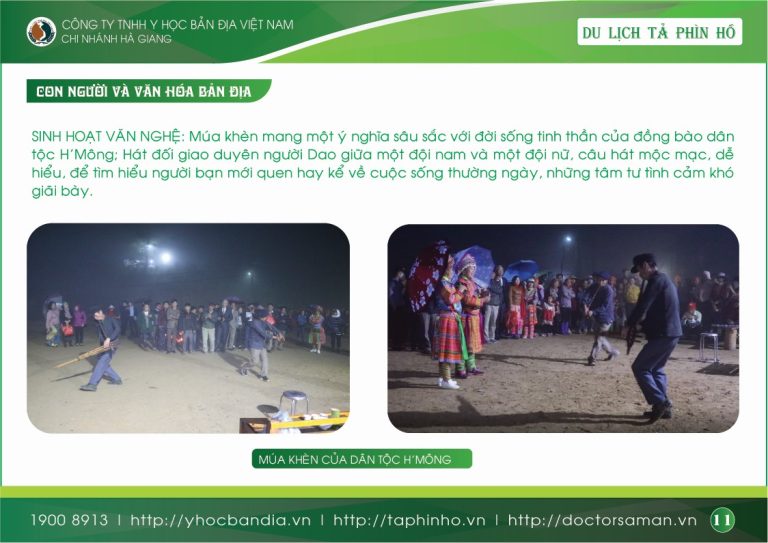
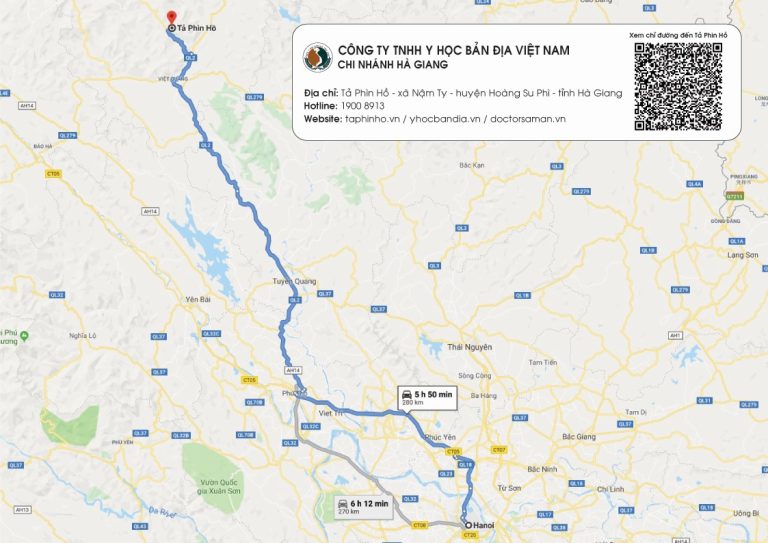
DU LỊCH TẢ PHÌN HỒ
NGHIÊN CỨU
ƯNG THƯ
Nghệ đen – Dược liệu tiềm năng chống ung thư phổi và tuyến tiền liệt
Nghệ đen (Curcuma zedoaria) hay còn gọi là Nga truật là một loại dược liệu thuộc họ Gừng (Zingiberaceae), được...
Read moreTIM MẠCH
BÀI MỚI
Nghệ đen – Dược liệu tiềm năng chống ung thư phổi và tuyến tiền liệt
Nghệ đen (Curcuma zedoaria) hay còn gọi là Nga truật là một loại dược liệu thuộc họ Gừng (Zingiberaceae), được...
Cúc thơm – Tiềm năng điều trị u đa tủy xương
Bệnh đa u tủy xương là một dạng ung thư máu nguy hiểm, khi các tế bào tương bào ác...
Tảo nâu – Tiềm năng điều trị u limpho
Tảo nâu Nhật Bản (Cladosiphon okamuranus Tokida), còn gọi là Mozuku, là một loại tảo biển thuộc họ Chordariaceae, phân...
Hạt bông
U đa tủy xương là một loại ung thư máu ác tính, phát sinh từ tế bào plasma trong tủy...
Cây Bằng lăng – Tiềm năng chống ung thư
Cây Bằng lăng (Lagerstroemia speciosa) là một loài thực vật thuộc họ Tử vi (Lythraceae), phân bố rộng rãi ở...
Các thuật ngữ liên quan đến ung thư và vai trò trong điều trị ung thư
1. Các yếu tố cấu thành để tế bào có thể thực hiện một lệnh theo yêu cầu - Con...
Trái Nhàu – Tiềm năng trong phòng và hỗ trợ điều trị ung thư
Trái nhàu (Morinda citrifolia L.), hay còn gọi là Noni, là quả của một loại cây nhiệt đới sử dụng...
Hiệu quả ức chế ung thư bàng quang của chiết xuất quả tiêu dài
Tiêu dài (Piper longum L.), còn gọi là tiêu lốt, là một loài thực vật thuộc họ Hồ tiêu (Piperaceae),...
Mãng cầu xiêm – Vị thuốc tiềm năng tác dụng trên ung thư máu, phổi và vú
Mãng cầu xiêm (ANNONA MURICATA (L.) hay còn gọi là na xiêm, được phân bố rộng rãi khắp Đông Nam...
Bạch chỉ – Tác dụng trên tiềm năng trên nhiều loại ung thư
Bạch chỉ (Angelica dahurica) là loài thực vật thuộc họ Hoa tán (Apiaceae), có nguồn gốc từ Đông Á và...
XEM NHIỀU NHẤT
-
Tìm hiểu trường sinh học để hiểu thêm về tâm linh, ngoại cảm, thần giao cách cảm, chữa bệnh từ xa… và một số điều trị “thần bí” khác (2)
-
Tự chăm sóc và khuyến cáo người cao tuổi trong mùa đông giá lạnh
-
Vượt qua cái chết chỉ với ba cây thuốc nam
-
Khung chậu sản khoa
-
Thảo dược với hẹp mạch vành theo dòng thời gian
-
Chè Shan Tuyết – đặc biệt với khả năng chống ung thư
-
Tuyến Cận Giáp
-
Kích thích âm vật: truy tìm liên hệ thần kinh âm vật – cột sống
-
Huperzin A sử dụng trong sản phẩm Neo 19 SAMAN được chiết xuất thế nào
-
Chữa loãng xương không cần cung cấp bổ sung canxi
© Copyright 2015 Vietnam Indigenous Medical Institute. All rights reserved. 2024 Viện Y Học Bản Địa Việt Nam Trang thông tin nghiên cứu khoa học và chuyển giao công nghệ của Viện Y học bản địa Việt Nam & Công ty TNHH Y học bản địa Việt Nam