Tóm tắt
Xơ cứng bì hệ thống (systemic sclerosis – SSc) là một bệnh tự miễn hiếm gặp nhưng nặng nề, đặc trưng bởi tổn thương mạch máu sớm, viêm mạn và xơ hóa lan tỏa da cùng cơ quan nội tạng. Căn nguyên bệnh vẫn chưa được giải thích đầy đủ, song nhiều bằng chứng chỉ ra tác nhân virus có thể đóng vai trò khởi phát. Trong số đó, Human Cytomegalovirus (HCMV), một thành viên họ Herpesviridae có khả năng tồn tại tiềm ẩn và tái hoạt động, được nghiên cứu nhiều nhất. Các dữ liệu miễn dịch học cho thấy kháng thể chống HCMV có thể phản ứng chéo với protein nội mô và nguyên bào sợi, đặc biệt thông qua cơ chế bắt chước phân tử giữa HCMV-UL94 và phân tử NAG-2 của người. Phản ứng này vừa gây apoptosis tế bào nội mô, vừa kích hoạt tăng sinh collagen ở nguyên bào sợi, từ đó hình thành nền tảng bệnh lý của SSc. Bài viết này tổng hợp chứng cứ dịch tễ, miễn dịch và cơ chế, đồng thời thảo luận giới hạn cũng như triển vọng nghiên cứu can thiệp.
Giới thiệu
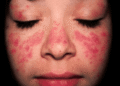
SSc là một trong những bệnh tự miễn hệ thống khó hiểu và khó điều trị nhất. Bệnh nhân có tỷ lệ tử vong cao, chủ yếu do tổn thương tim phổi và thận. Khác với lupus hay viêm khớp dạng thấp, xơ cứng bì nổi bật bởi sự kết hợp của ba quá trình: tổn thương mạch máu sớm, rối loạn miễn dịch và xơ hóa ngoại bào quá mức. Hội chứng Raynaud thường là biểu hiện khởi phát, cho thấy tổn thương vi mạch có mặt ngay từ giai đoạn đầu. Điều này gợi ý rằng căn nguyên phải xuất phát từ một yếu tố có khả năng tấn công trực tiếp hoặc gián tiếp lên nội mô. Trong vài thập kỷ qua, nhiều giả thuyết đề cập đến vai trò của virus, đặc biệt là HCMV.
Virus và Các Bệnh Tự Miễn Hệ Thống (2023) viết: “Mặc dù chưa được xác lập vững chắc như mối liên hệ EBV–Lupus, một giả thuyết cơ học rất thuyết phục đã tồn tại cho vai trò của Human Cytomegalovirus (HCMV) trong bệnh xơ cứng bì. Cơ chế được đề xuất liên quan đến sự bắt chước phân tử giữa protein UL94 của HCMV và phân tử NAG-2 trên tế bào người”. Đây chính là điểm tựa quan trọng để đi sâu phân tích.
Bằng chứng dịch tễ và miễn dịch học
HCMV là virus lây lan rộng, hơn 70% dân số trưởng thành từng nhiễm. Tuy nhiên, điều đáng chú ý là nhiều nghiên cứu đã ghi nhận dấu hiệu nhiễm hoặc tái hoạt HCMV ở bệnh nhân SSc cao hơn đối chứng. Các khảo sát huyết thanh học cho thấy tỉ lệ kháng thể chống HCMV IgG cao hơn ở SSc, và trong một số nghiên cứu, mức IgM hoặc DNA HCMV cũng được phát hiện trong máu bệnh nhân, gợi ý sự tái hoạt virus.
Một số nghiên cứu mô bệnh học còn phát hiện DNA hoặc protein HCMV trong mẫu sinh thiết da và phổi của bệnh nhân SSc. Điều này củng cố nhận định rằng HCMV không chỉ lưu hành trong cơ thể nói chung mà còn hiện diện ở đúng những cơ quan bị tổn thương.
Song song, một bằng chứng gián tiếp nhưng thuyết phục khác là sự xuất hiện của kháng thể phản ứng chéo. Kháng thể huyết thanh từ bệnh nhân SSc được chứng minh có thể nhận diện không chỉ kháng nguyên UL94 của HCMV, mà còn cả phân tử NAG-2 trên tế bào người. Hiện tượng này không thấy rõ ở người khỏe mạnh, chứng tỏ có sự tái định hướng đáp ứng miễn dịch đặc hiệu.
Cơ chế phân tử: UL94 và NAG-2
Cơ chế bệnh sinh trung tâm được đề xuất là bắt chước phân tử. UL94 là một glycoprotein vỏ của HCMV. Phân tử này có vùng tương đồng cấu trúc với NAG-2 – một protein bề mặt có mặt trên cả tế bào nội mô lẫn nguyên bào sợi.
Khi hệ miễn dịch tạo kháng thể chống UL94 trong quá trình nhiễm HCMV, kháng thể này cũng có thể gắn vào NAG-2 trên tế bào người. Hậu quả của phản ứng chéo này được quan sát ở hai mức:
- Trên tế bào nội mô, sự gắn kết dẫn đến kích hoạt apoptosis, tức chết theo chương trình. Đây là cơ chế giải thích hợp lý cho hiện tượng tổn thương mạch máu sớm và lan rộng, biểu hiện bằng hội chứng Raynaud và rối loạn vi tuần hoàn trong SSc.
- Trên nguyên bào sợi, cùng một loại kháng thể lại đóng vai trò tín hiệu kích hoạt. Nguyên bào sợi chuyển sang trạng thái hoạt động mạnh, tăng sinh và tăng sản xuất collagen cùng các thành phần chất nền ngoại bào. Hậu quả lâu dài là tình trạng xơ hóa da và cơ quan nội tạng, đặc điểm bệnh học chính của SSc.
Điều thú vị là cơ chế này gói gọn cả ba đặc trưng bệnh lý SSc: tổn thương nội mô, viêm và xơ hóa. Như vậy, chỉ với một phản ứng chéo đơn giản, toàn bộ bệnh cảnh lâm sàng có thể được lý giải.
Ngoài HCMV, Parvovirus B19 cũng từng được phát hiện trong mẫu sinh thiết bệnh nhân SSc. Virus này cũng có khả năng gây tổn thương nội mô, cho thấy SSc có thể do nhiều virus tham gia, nhưng HCMV là mô hình cơ chế rõ ràng nhất.
Thảo luận
Bằng chứng hiện có cho thấy vai trò HCMV trong SSc mang tính thuyết phục về cơ chế, nhưng vẫn còn hạn chế ở mức dịch tễ. Không phải mọi bệnh nhân SSc đều có dấu vết nhiễm hoặc tái hoạt HCMV. Mặt khác, HCMV rất phổ biến trong dân số, nhưng SSc lại hiếm gặp. Điều này hàm ý rằng HCMV chỉ là tác nhân khởi phát trên nền di truyền và miễn dịch thuận lợi.
Một giới hạn khác là chưa có nghiên cứu đoàn hệ quy mô lớn nào chứng minh mối liên hệ nhân–quả trực tiếp. Phần lớn dữ liệu hiện nay là quan sát cắt ngang, nghiên cứu mô học hoặc thí nghiệm in vitro. Chúng giúp xác định cơ chế tiềm năng nhưng không chứng minh được rằng nhiễm HCMV là điều kiện cần.
Dù vậy, giả thuyết UL94–NAG-2 vẫn là một trong những mô hình thuyết phục nhất hiện nay. Nó liên kết được các đặc điểm lâm sàng và bệnh học: từ Raynaud, vi mạch, đến xơ hóa. Nếu được củng cố bằng dữ liệu đoàn hệ, đây có thể trở thành chìa khóa giải thích toàn bộ bệnh sinh.
Hàm ý lâm sàng từ mối liên hệ này rất đáng chú ý. Thứ nhất, theo dõi tình trạng nhiễm hoặc tái hoạt HCMV ở bệnh nhân có hội chứng Raynaud tiên phát có thể giúp dự báo nguy cơ tiến triển thành SSc. Thứ hai, về điều trị, các thuốc kháng virus chống HCMV hoặc vắc xin phòng HCMV có thể mở ra hướng dự phòng và can thiệp sớm. Hiện tại chưa có thử nghiệm lâm sàng quy mô nào đánh giá chiến lược này, nhưng đây là một khoảng trống đáng khai thác. Cuối cùng, xét nghiệm kháng thể kháng UL94/NAG-2 có thể trở thành dấu ấn sinh học giúp chẩn đoán hoặc phân tầng bệnh nhân.
Kết luận
SSc là bệnh tự miễn phức tạp và khó điều trị, nhưng nghiên cứu về vai trò của HCMV đem lại một khung lý thuyết rõ ràng. Bằng chứng cho thấy kháng thể chống UL94 của HCMV có thể phản ứng chéo với protein NAG-2 trên tế bào nội mô và nguyên bào sợi, gây tổn thương vi mạch và kích hoạt xơ hóa. Cơ chế này phù hợp với toàn bộ diễn tiến bệnh học, từ Raynaud đến xơ hóa lan tỏa. Tuy nhiên, bằng chứng dịch tễ vẫn cần củng cố, và chưa có nghiên cứu can thiệp chứng minh mối liên hệ nhân–quả. Dẫu vậy, hướng đi này mở ra triển vọng nghiên cứu vắc xin, liệu pháp kháng virus và dấu ấn sinh học mới trong quản lý SSc.
Bác sĩ Hoàng Sầm & Hoàng Đôn Hoà.
Tài liệu tham khảo
-
Virus và Các Bệnh Tự Miễn Hệ Thống, Chương 2: Xơ cứng bì và HCMV, 2023.
-
Cơ Chế Gây Bệnh Cốt Lõi của Virus, Chương 2: Bắt chước phân tử, 2023.
-
Lunardi C, Dolcino M, Peterlana D et al. Antibodies against human cytomegalovirus-derived proteins cross-react with autoantigens in scleroderma. Proc Natl Acad Sci USA. 2000;97(12):6126–6131.
-
Sakkas LI et al. Viruses in systemic sclerosis: pathogenetic links and clinical implications. Autoimmun Rev. 2008;8(1):12–15.
-
Marcolongo R et al. Endothelial cell apoptosis induced by cytomegalovirus antibodies in systemic sclerosis. Clin Exp Immunol. 2005;140(3):543–550.
- Parodi A et al. Evidence for parvovirus B19 involvement in systemic sclerosis. Ann Rheum Dis. 2009;68(6):1024–1027.