Các phương pháp điều trị bệnh Parkinson mới
Tác giả: Thomas B. Stoker, Kelli M. Torsney; Người dịch: BS Hoàng Sầm
- John van Geest Center for Brain Repair, Khoa Khoa học Thần kinh Lâm sàng, Đại học Cambridge, Cambridge, Vương quốc Anh
- Wellcome Trust – Viện Tế bào gốc của Hội đồng Nghiên cứu Y khoa, Đại học Cambridge, Cambridge, Vương quốc Anh
- Khoa Thần kinh, Bệnh viện Đại học Cambridge NHS Foundation Trust, Cambridge, Vương quốc Anh
- Khoa Y học cho Người cao tuổi, Bệnh viện Đại học Cambridge NHS Foundation Trust, Cambridge, Vương quốc Anh
Bệnh Parkinson (PD) là bệnh thoái hóa thần kinh phổ biến thứ hai, biểu hiện là một rối loạn vận động đặc trưng với một số đặc điểm bổ sung không phải vận động. Dấu hiệu bệnh lý của PD là sự hiện diện của các tập hợp α-synuclein trong tế bào thần kinh (thể Lewy). Rối loạn vận động của PD xảy ra phần lớn do mất tế bào thần kinh dopaminergic của dây thần kinh đệm, dẫn đến sự suy giảm dopamine thể vân. Hiện chưa có phương pháp điều trị thay đổi bệnh đã được chứng minh cho PD, với các lựa chọn quản lý chủ yếu bao gồm thuốc dopaminergic, và kích thích não sâu ở một số ít bệnh nhân. Sử dụng lâu dài các liệu pháp dopaminergic đã được thiết lập cho PD dẫn đến các tác dụng phụ đáng kể, và do đó có yêu cầu phát triển các phương pháp tốt hơn để phục hồi dopamine thể vân, cũng như các phương pháp điều trị có khả năng làm chậm sự tiến triển của bệnh. Một số phương pháp điều trị thú vị đã mang lại kết quả đầy hứa hẹn trong các thử nghiệm lâm sàng tiền lâm sàng và giai đoạn đầu, và hiện tại có vẻ như bối cảnh quản lý PD sẽ thay đổi đáng kể trong tương lai ngắn hạn và trung hạn. Ở đây, chúng ta thảo luận về các liệu pháp dựa trên tế bào và gen tái tạo đầy hứa hẹn, được thiết kế để điều trị các khía cạnh dopaminergic của PD trong khi hạn chế các tác dụng phụ, cũng như các phương pháp mới để giảm bệnh lý α-synuclein.
Giới thiệu
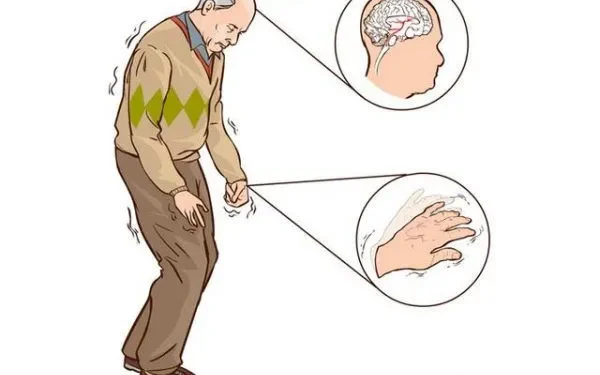
Bệnh Parkinson (PD) là bệnh thoái hóa thần kinh phổ biến thứ hai, biểu hiện điển hình với rối loạn vận động đặc trưng, bao gồm rối loạn vận động não, cứng khớp, run khi nghỉ ngơi và bất ổn tư thế (Kalia và Lang, 2015). Các biểu hiện khác ngoài vận động xảy ra, bao gồm trầm cảm, lo lắng, bất thường giấc ngủ, táo bón và suy giảm nhận thức kèm theo chứng sa sút trí tuệ, có thể làm giảm đáng kể chất lượng cuộc sống của bệnh nhân (Khoo và cộng sự, 2013).
Bệnh Parkinson (PD) biểu hiện điển hình với rối loạn vận động đặc trưng, bao gồm rối loạn vận động não, cứng khớp, run khi nghỉ ngơi và bất ổn tư thế
Về mặt bệnh lý, PD được đặc trưng bởi sự hiện diện của các tập hợp α-synuclein bất thường trong tế bào thần kinh, được gọi là thể Lewy và tế bào thần kinh thể Lewy (Spillantini và cộng sự, 1997). Trong khi vai trò cơ học của các thể Lewy chưa được hiểu đầy đủ, α-synuclein rõ ràng là trung tâm của cơ chế bệnh sinh của PD, như được nhấn mạnh bởi thực tế là các đột biến SNCA hiếm gặp, các bản sao hoặc các lần nhân ba gây ra PD gia đình trội trên NST thường (Klein và Westenberger, 2012). Rối loạn vận động của PD xảy ra một phần do sự mất chọn lọc các tế bào thần kinh dopaminergic của chất nền, dẫn đến sự suy giảm dopamine trong thể vân, trong khi các biểu hiện không vận động chủ yếu xảy ra do thoái hóa thần kinh lan rộng hơn, ảnh hưởng đến vỏ não và số lượng vùng thân não (Selikhova và cộng sự, 2009; Kalia và Lang, 2015). Mất dopaminergic cũng có những ảnh hưởng rộng hơn, bao gồm cả giấc ngủ và nhận thức (Williams-Gray và cộng sự, 2009).
Kể từ khi levodopa được giới thiệu vào những năm 1960, có rất ít sự phát triển trong điều trị PD. Không có phương pháp điều trị thay đổi bệnh và việc sử dụng levodopa mãn tính dẫn đến các tác dụng phụ đáng kể, bản thân chúng tạo thành một phần quan trọng của bệnh PD nâng cao (Jenner, 2003; Kalia và Lang, 2015). Tuy nhiên, một số phương pháp điều trị thú vị đã được áp dụng hoặc sẽ sớm bắt đầu trong các thử nghiệm lâm sàng, và bối cảnh điều trị PD có thể sẽ thay đổi đáng kể trong những thập kỷ tới. Trong bài đánh giá này, chúng tôi thảo luận về các phương pháp điều trị mới nổi và hình thức quản lý PD trong tương lai có thể áp dụng trong vài năm tới.
Các lựa chọn điều trị hiện tại cho bệnh Parkinson
Hiện tại không có phương pháp điều trị thay đổi bệnh cho PD và việc quản lý chủ yếu bao gồm thuốc dopaminergic. Thường được sử dụng nhất trong số này là các chế phẩm của levodopa, tiền chất của dopamine, được dùng kết hợp với chất ức chế dopa-decarboxylase có tác dụng hạn chế một số tác dụng phụ, chẳng hạn như buồn nôn. Thuốc chủ vận dopamine, chẳng hạn như ropinirole hoặc rotigotine, cũng được sử dụng. Các chất ức chế monoamine oxidase B, chẳng hạn như rasagiline và selegiline, và chất ức chế catechol-O-methyltransferase (COMT) như entacapone, có thể được sử dụng để làm giảm sự chuyển hóa của dopamine nội sinh. Những phương pháp điều trị này có thể khôi phục hoạt động dopaminergic trong thể vân, báo trước những cải thiện trong các tính năng vận động của PD. Tuy nhiên, chúng không điều trị được nhiều tính năng không vận động, đặc biệt gây tàn tật cho nhiều bệnh nhân. (Young và cộng sự, 1997; Kujawa và cộng sự, 2000).
Trong khi các phương pháp điều trị này có thể gây ra những cải thiện đáng kể trong các tính năng vận động của PD, đặc biệt là trong giai đoạn đầu, việc sử dụng levodopa kéo dài đặc biệt dẫn đến các tác dụng phụ đáng kể, tạo thành một phần quan trọng của bệnh cảnh lâm sàng trong PD nâng cao. Sự phân phối liên tục không sinh lý của dopamine đến thể vân được cho là cơ sở của rối loạn vận động có vấn đề (cử động rung giật bất thường không tự chủ) (Jenner, 2003; Huot và cộng sự, 2013), và những biến động đáng kể trong chức năng vận động có thể xảy ra do sự hấp thụ thất thường thuốc và sự biến đổi vận chuyển của levodopa vào não – tạo ra cái gọi là hiện tượng bật/tắt (Nutt và cộng sự, 1984). Những loại thuốc này cũng dẫn đến các tác dụng không đúng mục tiêu, dẫn đến việc phân phối chúng đến các vùng não khác ngoài thể vân, được cho là cơ sở cho các tác dụng phụ về tâm thần kinh có thể xảy ra, bao gồm ảo giác và rối loạn kiểm soát xung động (Ernst, 1969; Voon và cộng sự, 2009).
Các lựa chọn điều trị khác bao gồm kích thích não sâu (DBS), có thể rất hiệu quả trong việc kiểm soát rối loạn vận động của PD, nhưng giống như thuốc dopaminergic, nó không giúp được hầu hết các biểu hiện không vận động (Kalia et al., 2013). Mặc dù DBS là một phương pháp điều trị an toàn, nhưng có những tác dụng phụ tiềm ẩn có vấn đề khác bao gồm rối loạn chức năng nói và rối loạn tâm thần, cũng như những rủi ro chung liên quan đến thủ thuật phẫu thuật thần kinh, và phương pháp điều trị này chỉ phù hợp trong một số ít trường hợp PD (Benabid, 2003).
Một cách tiếp cận để cung cấp dopamine theo cách sinh lý hơn là sử dụng gel levodopa-ruột, dẫn đến giải phóng dopamine có thể dự đoán được nhiều hơn so với các chế phẩm uống. Điều này có thể hữu ích trong việc giảm các tác dụng phụ đối với vận động của điều trị dopaminergic, nhưng hiện đang rất đắt tiền để sử dụng rộng rãi và không phải là không có biến chứng do phẫu thuật cần thiết để đặt nó (Olanow và cộng sự, 2014). Ngoài ra, như với máy bơm DBS và máy bơm apomorphine, bệnh nhân được gắn vào một thiết bị luôn phải đeo, điều này không mong muốn đối với nhiều người.
Vì vậy, mặc dù có các lựa chọn điều trị hiệu quả cho các tính năng vận động của PD, nhưng chúng vẫn đi kèm với các vấn đề nghiêm trọng và không có phương pháp nào có thể làm chậm sự tiến triển của bệnh hoặc cải thiện việc vô hiệu hóa các tính năng không vận động. Thật vậy, một số tính năng phi vận động này thậm chí một phần được thúc đẩy bởi những loại thuốc này. Do đó, cần phải xác định các phương pháp mới để phục hồi dopamine thể vân một cách có mục tiêu và sinh lý, cũng như cần xác định các phương pháp điều trị có thể ngăn ngừa sự thoái hóa thần kinh đang diễn ra và sự tiến triển của bệnh. Một số phương pháp tiếp cận thử nghiệm hiện đang được nghiên cứu trong các nghiên cứu tiền lâm sàng và thử nghiệm lâm sàng, và có vẻ như việc điều trị PD sẽ có những thay đổi đáng kể trong những thập kỷ tới. Ở đây, chúng tôi thảo luận về một số cách tiếp cận điều trị triển vọng nhất.
Phục hồi thâm hụt dopaminergic
Điều trị nhiều triệu chứng vận động của PD có thể đạt được thông qua việc phục hồi trương lực dopaminergic thể vân. Điều này có thể được thực hiện thông qua việc phân phối có mục tiêu các tế bào sản xuất dopamine, hoặc sử dụng virus để đưa các gen mã hóa các enzym cần thiết cho quá trình sinh tổng hợp dopamine vào thể vân. Nhắm mục tiêu các phương pháp điều trị tái tạo này đến thể vân, vị trí mất dopamine nhiều nhất trong PD, sẽ giảm thiểu các tác dụng ngoài mục tiêu được thấy khi thay thế dopamine đường uống.
Phương pháp dựa trên tế bào
Nhiều nguồn tế bào hiện đã được nghiên cứu để cấy ghép trong PD, với các mức độ thành công khác nhau (Bảng 1: Barker và cộng sự, 2015). Việc sử dụng ghép mô trung gian não thất (VM) của bào thai ở người đã cung cấp bằng chứng về khái niệm rằng các phương pháp tiếp cận dựa trên tế bào như vậy có thể hiệu quả trong việc điều trị nhiều đặc điểm quan trọng của PD, nhưng các rào cản về đạo đức và hậu cần (chủ yếu là không thể đoán trước và cung cấp không đủ mô bào thai) có nghĩa là cách tiếp cận này sẽ không bao giờ là một liệu pháp chính khả thi cho tình trạng này (Barker và cộng sự, 2015). Điều bắt buộc, là một nguồn tái tạo các tế bào sản xuất dopamine, hoặc cơ quan sinh sản của chúng, có khả năng tích hợp vào não vật chủ, kéo dài các sợi trục qua khoảng cách thích hợp để bao bọc toàn bộ thể vân và tồn tại trong vật chủ trong nhiều năm. Các tiêu chí này có nhiều khả năng được đáp ứng bởi các tế bào thần kinh có nguồn gốc từ tế bào gốc, hiện cung cấp cách tiếp cận có khả năng nhất để cung cấp một liệu pháp dựa trên tế bào có thể mở rộng và hữu ích về mặt lâm sàng cho PD (Barker và cộng sự, 2018).
Các thử nghiệm về tế bào gốc đa năng cảm ứng và tế bào gốc đa năng (iPSC) được đánh dấu bởi tế bào gốc phôi (iPSC) sẽ bắt đầu trong một hoặc 2 năm tới (Barker và cộng sự, 2017). Chi tiết về thiết kế của những thử nghiệm này, bao gồm phương pháp phân phối tế bào, tiêu chí lựa chọn bệnh nhân, ức chế miễn dịch và điểm kết thúc nghiên cứu được thảo luận chi tiết ở bài khác (Barker và cộng sự, 2017). Các dòng ESC được phân lập từ phôi nang ban đầu, và được tạo ra từ phôi dư thừa của người có nguồn gốc từ quy trình thụ tinh trong ống nghiệm (Thomson và cộng sự, 1998). Giờ đây, chúng có thể được lập trình lại thành các tế bào sinh dục thần kinh dopaminergic ở não giữa với hiệu suất cao, đã được ghép một cách an toàn vào loài gặm nhấm, với việc phục hồi các khiếm khuyết về vận động (Kriks và cộng sự, 2011; Grealish và cộng sự, 2014). Cũng giống như các mảnh ghép trung gian bào thai của con người trước đây, các tế bào này sẽ là chất gây dị ứng, vì vậy có thể sẽ cần một thời gian ức chế miễn dịch, có liên quan đến các nguy cơ đối với vật chủ, bao gồm nhiễm trùng và bệnh ác tính (Gutierrez-Dalmau và Campistol, 2007). Tất nhiên, có những cân nhắc về mặt đạo đức với việc sử dụng mô phôi, nhưng trong hầu hết các nền văn hóa, điều này có thể được chấp nhận so với việc sử dụng mô bào thai (Barker và de Beaufort, 2013).
Ngược lại, iPSCs có nguồn gốc thông qua việc tái lập trình các tế bào soma như nguyên bào sợi, thành các tế bào đa năng, sau đó chúng có thể được chuyển đổi thành các tế bào sinh sản thần kinh dopaminergic (Takahashi và cộng sự, 2007; Kikuchi và cộng sự, 2017). Chúng đã được chứng minh là tích hợp vào thể vân vật chủ ở các loài linh trưởng không phải người, giúp cải thiện vận động mà không hình thành khối u sau 2 năm (Kikuchi và cộng sự, 2017). Khái niệm này rất hấp dẫn, vì nó có khả năng cung cấp các mô ghép mô tự thân, có thể tránh được nhu cầu về các chất ức chế miễn dịch. Tuy nhiên, một nhược điểm của việc sử dụng tế bào tự thân là sản phẩm ghép sẽ chứa bất kỳ yếu tố nhạy cảm với PD di truyền nào góp phần vào sự phát triển của PD ở vật chủ. Việc mắc phải bệnh lý PD đã được nhìn thấy trong các mảnh ghép VM thai nhi đồng loại và có thể điều này xảy ra nhanh hơn ở các tế bào có khuynh hướng di truyền cố hữu đối với loại bệnh lý này, có nghĩa là lợi ích của các mảnh ghép có nguồn gốc từ iPSC có thể bị mất sớm hơn so với để ghép có nguồn gốc từ ESC (Li và cộng sự, 2016). Trong khi việc tái lập trình ESC có thể tái tạo cao, cung cấp một sản phẩm tế bào nhất quán để sử dụng cho một số lượng lớn bệnh nhân, thì có một mức độ khác biệt cao giữa các cá thể trong quá trình tái lập trình nguyên bào sợi trưởng thành thành iPSCs và sự biệt hóa sau đó thành tế bào thần kinh. Điều này đặt ra những thách thức về quy định, vì mỗi dòng iPSC có nguồn gốc về cơ bản sẽ là một sản phẩm khác nhau và có khả năng phải được phê duyệt theo quy định và thử nghiệm tiền lâm sàng rộng rãi dẫn đến chi phí đáng kể. Tác động của điều này có thể giảm đi khi sử dụng haploban và chấp nhận mức độ không phù hợp kháng nguyên bạch cầu ở người (HLA), nhưng điều này có thể đòi hỏi phải sử dụng các tác nhân ức chế miễn dịch, có nghĩa là lợi thế chính của mô ghép có nguồn gốc từ iPSC bị mất (Taylor và cộng sự, 2012).
Mặc dù những phát triển trong lĩnh vực trị liệu dựa trên tế bào đã mất nhiều thập kỷ, vẫn còn nhiều hy vọng xung quanh các thử nghiệm sắp tới về ghép tiền thân thần kinh có nguồn gốc từ ESC và iPSC. Càng ngày, người ta càng xem xét tính thực tiễn của cách thức thực hiện các phương pháp điều trị này, làm nổi bật những tiến bộ đã đạt được đối với một liệu pháp dựa trên tế bào hữu ích.
Một nguồn tế bào gốc thay thế đã được coi là một phương tiện tiềm năng để điều trị PD là các tế bào gốc trung mô có nguồn gốc từ tủy xương (MSC). Đây là những tế bào đa năng có thể được biệt hóa thành tế bào tyrosine hydroxylase dương tính, chúng đã cải thiện hành vi vận động ở loài gặm nhấm bị tổn thương 6-hydroxydopamine (Offen và cộng sự, 2007). Tuy nhiên, sự biệt hóa thành các tế bào thần kinh dopaminergic đang gặp nhiều thách thức, chỉ có một số báo cáo được công bố về điều này (Trzaska và cộng sự, 2007), và tiện ích của MSC có thể phụ thuộc vào khoảng thời gian tối ưu hóa, như đã thấy với iPSC và ESC. Người ta cũng gợi ý rằng bản thân MSCs có thể có các đặc tính bảo vệ thần kinh thông qua hoạt động chống viêm và hoạt tính nội tiết, và chúng có thể hữu ích như một liệu pháp tái tạo ngay cả khi không có sự biệt hóa thành tế bào thần kinh dopaminergic (Kim YJ và cộng sự, 2009; Delcroix và cộng sự, 2011). MSC ghép đã được chuyển cho bệnh nhân PD trong một thử nghiệm nhãn mở nhỏ, với chứng minh an toàn trong thời gian ngắn (Venkataramana và cộng sự, 2010). Nghiên cứu này không thể đưa ra nhận xét về việc có hay không bất kỳ lợi ích lâm sàng nào, với thời gian theo dõi ngắn và vai trò của MSC trong tương lai vẫn chưa rõ ràng.
Mối quan tâm chính liên quan đến việc sử dụng các liệu pháp dựa trên tế bào gốc cho PD, là khả năng hình thành khối u trên lý thuyết. Điều này có thể xảy ra do sự phát triển quá mức của mảnh ghép hoặc sự hiện diện của đột biến gen sinh ung thư hoặc gen ức chế khối u trong tế bào được ghép. Mặc dù các khối u đã được nhìn thấy trong một số thử nghiệm tiền lâm sàng ban đầu về cấy ghép có nguồn gốc từ ESC, chúng chưa được quan sát thấy với các quy trình biệt hóa được cải thiện (Sonntag và cộng sự, 2007; Kikuchi và cộng sự, 2017). Tuy nhiên, thời gian theo dõi hạn chế có thể có ở các mô hình động vật nên được thừa nhận, và có thể xảy ra trong nhiều năm, như trường hợp của bệnh nhân PD, những mảnh ghép này có nguy cơ tạo khối u. Hơn nữa, việc giải thích các bất thường di truyền trong sản phẩm ghép là một thách thức và do đó, các thử nghiệm lâm sàng sắp tới đã áp dụng các chiến lược khác nhau để kiểm tra di truyền (Barker et al., 2017). Việc điều tra kỹ lưỡng về tính an toàn và giám sát kỹ lưỡng sẽ rất quan trọng để đảm bảo rằng nguy cơ hình thành khối u là không đáng kể, nếu những phương pháp điều trị này thành công.
Các phương pháp tiếp cận phân phối gen bằng virus
Một cách tiếp cận thay thế hướng tới điều trị tái tạo cho PD bao gồm việc sử dụng các vectơ virus để đạt được sự biểu hiện của các gen cụ thể trong thể vân. Chúng bao gồm các vectơ mang gen mã hóa các enzym chịu trách nhiệm sản xuất dopamine – amin thơm decarboxylase (AADC), tyrosine hydroxylase và cyclohydrolase-1.
Các vectơ vi-rút liên quan đến Adeno (AAV) mang AADC đã được chứng minh là dẫn đến biểu hiện gen chuyển kéo dài, với kết quả là sự chuyển đổi lâu dài của levodopa thành dopamine ở động vật linh trưởng không phải người (Bankiewicz và cộng sự, 2006). Các thử nghiệm giai đoạn I sau đó đã nghiên cứu tính an toàn của các vectơ AAV cung cấp AADC cho bệnh nhân PD (Christine và cộng sự, 2009; Muramatsu và cộng sự, 2010). Cả hai thử nghiệm đều báo cáo sự cải thiện các thông số hình ảnh lâm sàng và PET sau 6 tháng, và các quy trình được dung nạp tốt. Hai thử nghiệm lâm sàng giai đoạn I tiếp theo được thực hiện trên bệnh nhân PD sử dụng vectơ AAV đã được thực hiện, nhưng những thử nghiệm này đã áp dụng các phương pháp điều trị khác nhau. Một người đã sử dụng yếu tố dinh dưỡng cho tế bào thần kinh dopaminergic (neurturin) và người kia đã tìm cách thay đổi nhận dạng của các tế bào thần kinh đầu ra dưới đồi từ glutamatergic thành những tế bào biểu hiện axit glutamic-decarboxylase. Những thử nghiệm này cho thấy hứa hẹn ban đầu và hỗ trợ sự an toàn của các phương pháp tiếp cận liệu pháp dựa trên gen (Kaplitt và cộng sự, 2007 ; Marks và cộng sự, 2008). Tuy nhiên, các thử nghiệm ngẫu nhiên giai đoạn II không có nhiều hứa hẹn, không cho thấy hoặc chỉ có lợi ích nhẹ so với giả dược (Marks và cộng sự, 2010; LeWitt và cộng sự, 2011). Các vectơ AAV là các vectơ không tích hợp, do đó không mang nguy cơ gây đột biến chèn có thể xảy ra với các vectơ virut tích hợp (Mukherjee và Thrasher, 2013). Tuy nhiên, nhược điểm chính của vectơ AAV là kích thước tiềm năng của chất liệu di truyền tương đối hạn chế, có nghĩa là gen của chỉ một trong số các enzym trong con đường tổng hợp dopamine có thể được phân phối trong các thử nghiệm nói trên.
Ngược lại, các vectơ lentivirus đang tích hợp các vectơ virus, với khả năng chứa chất liệu di truyền lớn hơn nhiều so với AAV – một thuộc tính đã được khai thác trong các thử nghiệm phân phối gen của virus (Palfi và cộng sự, 2014). ProSavin (Oxford Biomedica, Vương quốc Anh) là một sản phẩm phân tử có chứa các gen cho AADC, cùng với các gen cho tyrosine hydroxylase và cyclohydrolase-1. Một thử nghiệm giai đoạn I/II cho thấy sản phẩm này được dung nạp tốt, mặc dù một số lượng đáng kể bệnh nhân bị rối loạn vận động khi dùng thuốc tăng lên (Palfi và cộng sự, 2014). Một bản thử nghiệm tiếp theo của phiên bản ProSavin mới, OXB -102, sắp bắt đầu ở Vương quốc Anh và Pháp.
α-Synuclein như một mục tiêu điều trị
Sự tích tụ và tập hợp của α-synuclein là dấu hiệu bệnh lý của PD, và mặc dù vai trò của nó chưa được hiểu hoàn toàn, nhưng nó có vẻ quan trọng trong quá trình sinh bệnh của PD (và các bệnh α-synuclein khác như sa sút trí tuệ với thể Lewy và teo nhiều hệ thống) (Spillantini và cộng sự, 1997). Do đó, việc giảm mức độ các dạng bệnh lý của α-synuclein có thể làm thay đổi quá trình PD. Một số phương pháp tiếp cận thử nghiệm đã được nghiên cứu hoặc hiện đang được nghiên cứu về khả năng của chúng trong việc có khả năng mang lại tác dụng điều chỉnh bệnh trong PD thông qua việc nhắm mục tiêu α-synuclein. Ở đây, chúng tôi cung cấp tổng quan về một số cách tiếp cận hứa hẹn nhất.
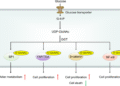
Hình mục tiêu điều trị trong bệnh lý qua trung gian α-synuclein. DNA, axit deoxyribonucleic; mARN, axit ribonucleic thông tin; ARN, axit ribonucleic.
Giảm sản xuất α-Synuclein
Một cơ chế mà tác dụng bệnh lý của α-synuclein có thể được giảm thiểu là giảm sự tổng hợp của nó. Điều này có thể đạt được thông qua công nghệ can thiệp RNA, trong đó việc đưa vào ngoại sinh các phân tử axit ribonucleic tổng hợp (RNA) được sử dụng để kích hoạt sự im lặng sau phiên mã có chọn lọc của gen α-synuclein, thông qua sự phân hủy RNA thông tin (mRNA). Sự phân phối ngoại vi của một RNA kẹp ngắn (shRNA) nhắm vào α-synuclein đã được chứng minh là có thể ngăn chặn sự biểu hiện α-synuclein ngoài tử cung ở mô hình động vật gặm nhấm và trong tế bào SH-SY5Y, hỗ trợ cho khái niệm này (Sapru và cộng sự, 2006). Ngoài ra, việc truyền trực tiếp RNA can thiệp nhỏ (siRNA) chống lại α-synuclein vào hồi hải mã của chuột dẫn đến làm giảm sự biểu hiện của α-synuclein (Lewis và cộng sự, 2008). Tiếp theo từ đó, nghiên cứu được tiến hành ở các động vật linh trưởng không phải người, trong đó tiêm truyền siRNA có chỉ thị chống lại α-synuclein, đã chứng minh sự giảm mRNA α-synuclein và giảm 40–50% mức protein α-synuclein (McCormack và cộng sự, 2010). Vẫn còn phải xem liệu việc giảm mức độ α-synuclein này có chuyển thành lợi ích lâm sàng hay không, nhưng việc chứng minh rằng các kỹ thuật này có khả năng làm giảm mức độ α-synuclein chắc chắn là đầy hứa hẹn.
Tất nhiên, một mối lo ngại đối với việc ức chế sản xuất α-synuclein là có thể có những tác động tiêu cực do sự im lặng của α-synuclein bình thường và làm mất chức năng sinh lý bình thường của nó. Chức năng này vẫn chưa được hiểu rõ hoàn toàn, nhưng nó dường như đóng một vai trò trong việc gắn kết không bào vào màng tế bào, vì vậy có thể rất quan trọng trong việc giải phóng chất dẫn truyền thần kinh (Burré et al., 2014). Chắc chắn rằng, mặc dù giảm mức độ α-synuclein trong các mô hình động vật gặm nhấm được thảo luận, việc ức chế α-synuclein không dẫn đến bất kỳ độc tính nào (Lewis và cộng sự, 2008). Tuy nhiên, các nghiên cứu khác đã báo cáo độc tính thần kinh đáng kể liên quan đến việc ức chế α-synuclein, bao gồm cả trong nigra pars compacta (Robertson và cộng sự, 2004; Gorbatyuk và cộng sự, 2010; Kanaan và Manfredsson, 2012). Trong một trong những nghiên cứu này, sự thoái hóa thần kinh có thể được cứu vãn bằng cách bổ sung nồng độ α-synuclein, cho thấy rằng việc mất đi α-synuclein thực sự là nguyên nhân dẫn đến bệnh lý (Gorbatyuk và cộng sự, 2010). Các báo cáo này nhấn mạnh sự cần thiết phải có đầy đủ dữ liệu an toàn nếu các kỹ thuật này được phát triển từ các nghiên cứu tiền lâm sàng đến lâm sàng.
Trong khi các phương pháp tiếp cận dựa trên RNA này làm giảm quá trình dịch mã của gen α-synuclein, thì mục tiêu thay thế sẽ là giảm sự phiên mã của gen α-synuclein. Gần đây, chất chủ vận thụ thể β2-adrenergic (chất chủ vận β2) bao gồm clenbuterol, có liên quan đến việc giảm biểu hiện gen α-synuclein (Mittal và cộng sự, 2017). Clenbuterol, một loại thuốc được sử dụng trong điều trị bệnh hen suyễn, đã được chứng minh là làm giảm 35% biểu hiện α-synuclein trong dòng tế bào u nguyên bào thần kinh và tế bào thần kinh vỏ não chuột. Ngoài ra, nó có khả năng vượt qua hàng rào máu não – một yêu cầu cần thiết cho bất kỳ phương pháp điều trị nào được đề xuất này (Mittal và cộng sự, 2017). Các thử nghiệm tiền lâm sàng này đã được hỗ trợ bởi kết quả của hai nhóm thuần tập dịch tễ học lớn của Na Uy, trong đó bốn triệu cá nhân được theo dõi. Trong đó, chất chủ vận β2 có liên quan đến việc giảm nguy cơ phát triển PD. Ngược lại, thuốc đối kháng β2 (như propranolol) có liên quan đến việc tăng nguy cơ PD (Mittal và cộng sự, 2017). Mặc dù mối liên quan này đòi hỏi phải điều tra thêm, nhưng triển vọng rằng chất chủ vận β2 có thể cung cấp tác dụng điều chỉnh bệnh ở PD là một điều thú vị, đặc biệt là do đã có nhiều kinh nghiệm về việc sử dụng các thuốc này cho các bệnh lý khác, có nghĩa là đến phòng khám có thể tương đối nhanh chóng.
Tăng độ thanh thải α-Synuclein
Một cách tiếp cận thay thế để nhắm mục tiêu α-synuclein, là tăng cường độ thanh thải của nó. Điều này có thể đạt được thông qua việc tăng sự phân hủy nội bào của α-synuclein thông qua các con đường tự thực (autophagy-người dịch) và hệ thống ubiquitin-proteasome chẳng hạn, hoặc bằng cách sử dụng các liệu pháp miễn dịch để loại bỏ α-synuclein ngoài tế bào, đặc biệt khi người ta đã giả thuyết rằng α -synuclein bệnh lý có thể lây lan giữa các tế bào theo kiểu prion.
Liệu pháp miễn dịch
Liệu pháp miễn dịch chủ động và thụ động đã được nghiên cứu như một phương tiện để nhắm mục tiêu và phân hủy α-synuclein ngoại bào, và đã được chứng minh là làm giảm sự tập hợp α-synuclein và ngăn ngừa sự thiếu hụt hành vi ở chuột chuyển gen (George và Brundin, 2015). Một số phương pháp điều trị này đã được thử nghiệm lâm sàng, với dữ liệu an toàn đầy hứa hẹn và kết quả sớm (Brundin và cộng sự, 2017).
Một thử nghiệm lâm sàng giai đoạn I của vắc xin điều trị miễn dịch tích cực (AFFITOPE PD03A, AFFiRiS, Áo) gần đây đã được hoàn thành1 . Đây là loại vắc-xin được sản xuất tổng hợp có chứa peptit bắt chước α-synuclein. Trong thử nghiệm này, bệnh nhân mắc chứng PD giai đoạn đầu được tiêm AFFITOPE PD03A dưới da lặp lại. Ba mươi sáu bệnh nhân được chọn ngẫu nhiên để sử dụng AFFITOPE PD03A liều cao hoặc liều thấp hoặc giả dược. Một phản ứng miễn dịch phụ thuộc vào liều lượng đối với peptit, cũng như phản ứng chéo với α-synuclein, đã được báo cáo, với hiệu giá kháng thể tăng dần theo thời gian . Khuyến khích rằng cả hai liều đều được dung nạp tốt và không có tác dụng phụ nghiêm trọng liên quan đến thuốc được báo cáo. Một trong những liệu pháp miễn dịch hoạt động khác của công ty, PD01A, đã được báo cáo là an toàn ở giai đoạn đầu PD, trong hơn 4 năm .
Phương pháp tiếp cận liệu pháp miễn dịch thụ động sử dụng kháng thể đơn dòng được nhân bản hóa chống lại α-synuclein (PRX001) cũng đã được thử nghiệm. Prothena đã tiến hành một thử nghiệm lâm sàng giai đoạn Ia cho thấy mức độ giảm α-synuclein lên đến 96,5% ở những người tình nguyện khỏe mạnh và một thử nghiệm giai đoạn 1b tiếp theo ở bệnh nhân PD, trong đó mức độ α-synuclein cũng giảm xuống (Schenk và cộng sự, 2017). PRX001 được dung nạp tốt và một thử nghiệm giai đoạn II ở bệnh nhân PD giai đoạn đầu hiện đang được tiến hành.
Các liệu pháp miễn dịch bổ sung nhắm mục tiêu vào α-synuclein đang được triển khai, với các công ty dược phẩm AstraZeneca và Takeda công bố sự phát triển của kháng thể α-synuclein MEDI1341 cho PD. Thông cáo báo chí liên quan đến MEDI1341 tuyên bố rằng thuốc này có ái lực cao với mục tiêu và giảm chức năng tác dụng, có khả năng cung cấp phương pháp điều trị an toàn và hiệu quả hơn, so với các liệu pháp miễn dịch α-synuclein khác.
Nâng cao tính năng Tự thực
Cơ chế đề xuất cho liệu pháp miễn dịch đã được thảo luận là thanh thải α-synuclein ngoại bào, nhưng cũng có thể thanh thải α-synuclein trong tế bào thông qua các phương tiện khác. Hệ thống lysosome-tự thực đóng một vai trò quan trọng trong việc thanh thải α-synuclein, thông qua cả tự thực qua trung gian chaperone và macro tự thực (Decressac và cộng sự, 2013). Do đó, tăng cường hoạt động trong hệ thống này có thể làm giảm mức độ α-synuclein, và xu hướng tích tụ và tổng hợp của nó. Một số loại thuốc đã được nghiên cứu như là một phương tiện tiềm năng để có thể kích hoạt tự thực, bao gồm các tác nhân mới cũng như việc thay thế thuốc với các chỉ định đã được thiết lập khác.
Ví dụ như Rapamycin, trong lịch sử đã được sử dụng như một chất ức chế miễn dịch và là một chất gây bệnh macro tự thực đã được thiết lập tốt (Moors và cộng sự, 2017), và nó đã được chứng minh là làm giảm sự tích tụ α-synuclein trong mô hình in vitro của đột biến GBA1. – PD liên kết (Cullen và cộng sự, 2011). Mặc dù hồ sơ tác dụng phụ bất lợi của rapamycin có nghĩa là không có khả năng hữu ích như một phương pháp điều trị mãn tính cho PD, nhưng kết quả như vậy cho thấy rằng việc tăng cường tự thực thực sự có thể làm giảm tổng mức α-synuclein (Cullen et al., 2011; Moors et al. , 2017). Một số hợp chất đã được đề xuất để tăng hoạt động tự thực, bao gồm ví dụ như disaccharide trehalose (Sarkar và cộng sự, 2007; Rodríguez-Navarro và cộng sự, 2010) và thuốc chống trầm cảm ba vòng Nortriptyline (Gassen và cộng sự, 2014), đang được xem xét để đưa vào thử nghiệm lâm sàng.
Trehalose được quan tâm đặc biệt vì đã được chứng minh là làm giảm sự kết tụ protein trong các mô hình của các bệnh thoái hóa thần kinh khác (Tanaka và cộng sự, 2004; Davies và cộng sự, 2006). Trehalose là một disaccharide xuất hiện tự nhiên, đóng một vai trò quan trọng trong phản ứng tình trạng bất lợi ở nấm men (Singer và Lindquist, 1998). Trong khi người ta cho rằng khả năng làm giảm sự tập hợp protein của nó xảy ra do hoạt động của chaperone, hoặc thông qua liên kết và ổn định các protein bất thường (Tanaka và cộng sự, 2004; Davies và cộng sự, 2006), nó cũng đã được chứng minh là có tác dụng thông qua một con đường độc lập với mTOR để tăng khả năng tự thực (Sarkar et al., 2007; Rodríguez-Navarro et al., 2010). Những nghiên cứu này rõ ràng đã thúc đẩy sự quan tâm đến hợp chất này, mặc dù một nghiên cứu gần đây về tế bào thần kinh vỏ não chính của chuột phát hiện ra rằng trehalose không ngăn chặn độc tính khi tiếp xúc với các sợi α-synuclein hình thành trước (Redmann và cộng sự, 2017).
Với sự hiểu biết ngày càng cao về cơ sở di truyền của PD, ngày càng rõ ràng rằng các cơ chế gây bệnh khác nhau có thể rõ ràng hơn ở một số nhóm bệnh nhân nhất định. Do đó, khi kiến thức của chúng ta về các dạng phụ bệnh lý của PD được mở rộng, thì các phương pháp điều trị nhắm mục tiêu khác nhau có thể xuất hiện. Đột biến GBA1 là yếu tố nguy cơ di truyền phổ biến nhất đối với PD (Sidransky và cộng sự, 2009). Các GBA1 mã hóa gen cho enzyme β-glucocerebrosidase (GCase), và đột biến đồng hợp tử trong kết quả gen này trong rối loạn lưu trữ lysosome, bệnh Gaucher (Migdalska-Richards và Schapira năm 2016). Mặc dù cơ chế mà GBA1Các đột biến làm tăng nguy cơ PD vẫn chưa được hiểu đầy đủ, có một tài liệu đã được thiết lập cho thấy rằng rối loạn chức năng của hệ thống lysosome-tự thực bị suy giảm trong bối cảnh này (Schöndorf et al., 2014 ; Bae et al., 2015 ; Fernandes et al., 2016). Do đó, ở nhóm bệnh nhân này, việc nhắm mục tiêu tự thực có thể có liên quan đặc biệt. Có hai thử nghiệm lâm sàng đang diễn ra trong đó bệnh nhân PD có đột biến GBA1 đang được điều trị nhằm mục đích sửa chữa những bất thường trong môi trường lysosome. Trong thử nghiệm đầu tiên, giai đoạn II (MOVES-PD, Genzyme / Sanofi), bệnh nhân được nhận một hợp chất có tên GZ / SAR402671. Điều này ức chế sản xuất glycosphingolipid, thường được dị hóa bởi GCase, và tích tụ trong tế bào ở bệnh nhân PD có đột biến GBA1. Mặt khác, ambroxol, được Cơ quan Quản lý Thực phẩm và Dược phẩm (FDA) phê duyệt, đang được nghiên cứu như một phương pháp điều trị tiềm năng cho PD liên quan đến đột biến GBA1 (Số nhận dạng ClinicalTrials.gov : NCT02941822 và NCT02914366). Ambroxol có đặc tính chaperone, vì vậy có khả năng tạo điều kiện thuận lợi cho việc vận chuyển GCase đã được gấp lại sai vào lysosome (Maegawa và cộng sự, 2009). Trong in vitro nghiên cứu, nó cải thiện chức năng lysosome trong nguyên bào sợi da với GBA1 đột biến (Bendikov-Bar et al, 2013. ;McNeill và cộng sự, 2014) và làm tăng hoạt động của GCase ở động vật linh trưởng không phải con người in vivo (Migdalska-Richards và cộng sự, 2017).
Thay thế các loại thuốc khác
Hai loại thuốc khác gần đây đã được sử dụng lại và thử nghiệm trên bệnh nhân PD – chất chủ vận glucagon-like peptide-1 (GLP-1), exenatide, và chất ức chế tyrosine kinase, nilotinib.
Exenatide là một phương pháp điều trị đã được thành lập cho bệnh tiểu đường loại hai (Lovshin và Drucker, 2009), trong khi nilotinib được sử dụng trong điều trị bệnh bạch cầu nguyên bào tủy mãn tính, vì vậy dữ liệu đã tồn tại về tính an toàn và khả năng dung nạp của các tác nhân này trong quần thể bệnh nhân, điều này đã giúp tiến hành tiến bộ thông qua các thử nghiệm lâm sàng, cho thấy kết quả đầy hứa hẹn.
Exenatide đã được chứng minh là cung cấp các tác dụng bảo vệ thần kinh và phục hồi thần kinh trong các mô hình động vật gặm nhấm dựa trên độc tố của sự thoái hóa nigrostriatal, với những cải thiện về chức năng vận động, hành vi, học tập và trí nhớ (Bertilsson và cộng sự, 2008 ; Kim S. và cộng sự, 2009) . Một thử nghiệm mù đôi có đối chứng với giả dược gần đây đã nghiên cứu tác dụng của exenatide dưới da ở những bệnh nhân có PD trung bình (Athauda và cộng sự, 2017). Việc điều trị có liên quan đến những tác động tích cực và lâu dài đối với điểm vận động khi không dùng thuốc sau 60 tuần. Trong bối cảnh PD, thời gian theo dõi này tương đối ngắn, và vẫn chưa rõ liệu thuốc này có làm giảm sự tiến triển của thoái hóa thần kinh trong PD hay không, nhưng những kết quả ban đầu này có vẻ đầy hứa hẹn (Athauda và cộng sự, 2017).
Nilotinib đã được chứng minh là tăng cường sự thanh thải amyloid, và do đó được coi là một phương tiện tiềm năng để giảm mức độ α-synuclein (Lonskaya và cộng sự, 2014). Nó hoạt động như một chất ức chế c-abl, một gen gây ung thư liên quan đến việc điều chỉnh sự phát triển, biệt hóa, tăng sinh và tồn tại của tế bào. Mức độ c-abl tăng lên có liên quan đến PD, được cho là dẫn đến sự gia tăng quá trình phosphoryl hóa và tổng hợp α-synuclein (Brahmachari et al., 2016 ; Lindholm et al., 2016). Ngoài ra, sự gia tăng hoạt động của c-abl dẫn đến giảm chức năng của parkin, một protein quan trọng trong quá trình sinh học ty thể, và trong đó đột biến dẫn đến PD gia đình (Lonskaya và cộng sự, 2014). Nilotinib đã được chứng minh là làm giảm mức độ α-synuclein biểu hiện ngoại sinh ở chuột và làm giảm sự thoái hóa nigral do α-synuclein gây ra (Hebron và cộng sự, 2013). Một nghiên cứu mở gần đây trong đó bệnh nhân PD bị sa sút trí tuệ hoặc sa sút trí tuệ thể thể Lewy được dùng nilotinib, đã chứng minh tính an toàn và khả năng dung nạp của thuốc ở những nhóm này, ở liều 150 và 300 mg (thấp hơn liều được sử dụng trong các chỉ định đã được thiết lập) Pagan và cộng sự, 2016). Tuy nhiên, nghiên cứu này không liên quan đến nhóm giả dược và có sự khác biệt cơ bản đáng kể giữa hai nhóm nhỏ, vì vậy không thể nhận xét về bất kỳ lợi ích lâm sàng nào mà thuốc có thể mang lại. Mặc dù các nghiên cứu tiền lâm sàng đưa ra triển vọng thú vị cho nilotinib, nhưng vẫn chưa có bằng chứng thuyết phục về hiệu quả của nó ở bệnh nhân PD (Wyse và cộng sự, 2016), mặc dù một thử nghiệm khác (NILO-PD) với tác nhân này hiện đang được tiến hành trong Hoa Kỳ (Mã định danh ClinicalTrials.gov : NCT03205488).
Phần kết luận
Các lựa chọn điều trị hiện tại cho PD được giới hạn trong các biện pháp điều trị triệu chứng, chủ yếu ở dạng thuốc dopaminergic và DBS. Mặc dù chúng có thể mang lại lợi ích đáng kể về mặt triệu chứng, nhưng chúng cũng dẫn đến các tác dụng phụ đáng lo ngại, có thể làm giảm chất lượng cuộc sống của bệnh nhân. Hơn nữa, không điều nào trong số này làm thay đổi tiến trình của bệnh. Do đó, cần phải phát triển các phương pháp điều trị có thể phục hồi trương lực dopaminergic trong thể vân, theo cách có mục tiêu, sinh lý và xác định các loại thuốc có thể ngăn chặn hoặc làm chậm quá trình thoái hóa thần kinh đang diễn ra. Một số phương pháp điều trị thú vị đang bắt đầu đi vào thử nghiệm lâm sàng. Chúng bao gồm các phương pháp điều trị tái tạo dưới hình thức ghép có nguồn gốc từ tế bào gốc và các liệu pháp gen virus được thiết kế để thay thế chức năng của các tế bào thần kinh đã bị mất, cũng như các loại thuốc mới và được sử dụng lại nhắm vào các cơ chế gây bệnh của PD, với các đặc tính có khả năng sửa đổi bệnh. Việc mở rộng kiến thức về sinh lý bệnh và di truyền của PD, đã cho phép phát triển các phương pháp điều trị cụ thể, và có khả năng phương pháp điều trị tiêu chuẩn của PD sẽ được thay đổi đáng kể trong những thập kỷ tới, khi các lựa chọn điều trị mới này xuất hiện và được sử dụng kết hợp .
Sự đóng góp của tác giả
TS và KT đã đóng góp như nhau trong việc viết bản thảo. RB đã xem xét và chỉnh sửa bản thảo.
Kinh phí
Các tác giả thừa nhận sự hỗ trợ tài chính từ các tổ chức sau: Viện Tế bào gốc Wellcome Trust (Cambridge), Hội đồng Nghiên cứu Y tế, Trung tâm Nghiên cứu Y sinh Viện Nghiên cứu Sức khỏe Quốc gia và Tổ chức Cure Parkinson’s Trust.
Xung đột về tuyên bố lợi ích
Các tác giả tuyên bố rằng nghiên cứu được thực hiện trong trường hợp không có bất kỳ mối quan hệ thương mại hoặc tài chính nào có thể được hiểu là xung đột lợi ích tiềm ẩn.
Người dịch: Bác sỹ Hoàng Sầm